玻璃酸钠动物膝关节腔内分布示踪模型的建立
2015-01-29 作者:罗裕强, 林炳权, 肖军,史占军 点击量:1395 我要说
罗裕强1 林炳权2 肖军1 史占军1
1南方医科大学南方医院 关节与骨病外科 广州510515
2南方医科大学南方医院 影像中心 广州510515
摘要:目的 运用双源CT扫描及X线透视技术建立玻璃酸钠(HyaluronicAcid,HA)在兔膝关节腔内分布的示踪模型,并观察给药位点差异对HA在兔膝关节腔内分布范围的影响。方法 以碘海醇为示踪剂,分别配制碘海醇浓度为2.5%、5%、10%、20%、40%的玻璃酸钠-碘海醇(HA-I)混合制剂各0.5ml,注入兔膝关节腔后,运用双源CT进行平扫和三维重建,筛选能够有效区分药物和周边组织的最佳示踪剂浓度。随后,分别从髌骨下和关节线两种给药位点向兔膝关节腔注射最佳碘海醇浓度的HA-I制剂0.5ml,应用双源CT及X线透视观察药物在膝关节腔内分布特征的差异,确认该药物示踪模型的有效性。结果 HA-I混合制剂的CT值随着碘海醇浓度增加而递增,碘海醇浓度分别为2.5%、5%、10%、20%、40%时,膝关节软组织、HA-I制剂及骨组织三者的平均CT值比值分别为2:7:46,2:14:44,2:28:44,2:60:46,2:98:45,证实5%~10%碘海醇浓度的HA-I混合制剂可最有效区分药物和周边组织,获得最理想的药物分布范围三维重建效果。取5%碘海醇浓度的HA-I制剂进行CT扫描和X线透视示踪观察,结果提示给药位点差异与药物分布范围存在相关性,髌骨下给药的HA主要分布于髌股关节,关节线给药的HA则主要分布于胫股关节。结论5%碘海醇浓度的HA-I制剂配合CT扫描及X线透视技术,可有效区分药物和周边组织,直观显示药物在关节腔的分布范围,是一种可靠的HA药物示踪模型。
关键词:玻璃酸钠;膝关节;碘海醇;动物模型
Iohexol TracingHyaluronic Acid Distribution inside Knee Articulation Cavity in A Rabbit Model
LUO Yu-qiang1, LIN Bing-quan2, XIAO Jun1 ,SHI Zhan-jun1
1 Department of Joint Surgery,Nanfang Hospital, Southern Medical University,
Guangzhou 510515, China
2 Imaging Center, NanfangHospital, Southern Medical University,
Guangzhou 510515, China
Abstract:Objective The aim of this study wasto establish a tracing model of hyaluronic acid (HA) distribution in rabbitknee articulation cavity using CT plain scan, three dimensional reconstruction and X-ray perspective technology and observe how injectionsite diversity influences HA distribution. MethodsHA was interfused with iohexol as a tracer, andiohexol concentration of the composite was 2.5%, 5%, 10%, 20% and 40% respectively.Afterwards 0.5ml HA-iohexol composite ofdifferent concentration was injected into rabbit knees. Dual-source CT was conductedto gain plain scan and three-dimensional reconstruction images for each knee. TheCT value and quality of images was evaluated to screen the compatibleconcentration of the tracing agent. Two different knees were administeredwith 0.5ml HA-I composite with compatibleconcentration of the tracing agent through the patella medial approach andthe medial joint line approach. Afterwards, CT and X-ray perspective were underwent tocompare the HA distribution in knee cavity injected through two differentinjection approaches. Results TheCT value of HA-iohexol composite increased progressively with the tracer at ahigher concentration. The ratio of CT value of sofetissue, HA-I composite and bone cortex were respectively 2:7:46, 2:14:44, 2:28:44,2:60:46, 2:98:45. The images corresponding 2.5%, 20% and 40% HA-iohexol werenot qualified, whereas that of 5% and 10% were appropriate for tracing thedistribution of HA inside rabbit knee articulation. The CT scan and X-rayperspective showed that HA injected through themedial-patellar approach tended to be distributed mainly over the patella-femoralarticulation. Whereas HA injected through the joint line approach tended to bedistributed mainly over the tibio-femoral articulation. Conclusion HA distribution was presented with favorable discrimination frombone cortex and soft tissue in rabbit knee articulation utilizing 5% HA-iohexolcomposite. The model indicated that injection approach diversity influenced HAdistribution in knee articulation cavity.
Key words: HyaluronicAcid; Knee Articulation;Iohexol; Animal Model
膝关节腔内注射玻璃酸钠(Hyaluronic Acid,HA)作为治疗膝关节骨关节炎(KneeOsteoarthritis,KOA)的手段之一,学术界对其治疗KOA的疗效一直争议不断,不同临床研究之间观点尖锐对立,大量研究指出HA可有效缓解KOA症状并改善膝关节功能[1, 2],但也有文献认为其缺乏临床疗效[3]。为探索上述观点对立的根源,本研究组回顾文献发现,所有临床研究均未标注HA的给药位点----给药位点差异若可导致HA在关节腔内分布范围不同,则很可能是造成结果偏歧的原因。而观察不同给药位点对HA在膝关节腔内分布范围的影响,则需要首先建立一种能够用于观察HA在膝关节腔内分布情况的有效模型。因此,本研究拟在HA制剂内掺入适量碘海醇作为示踪手段,以CT三维重建和X透视下动态显影为研究手段[4, 5],建立HA在兔膝关节腔内分布的成像模型,为进一步了解给药位点差异是否造成HA在关节腔内的分布差异奠定基础。
1 材料与方法
1.1 HA-I混合制剂的制备与均一性评价
将HA注射液(佰备,上海景峰制药股份有限公司)与碘海醇注射液(欧苏,扬子江药业集团有限公司)均匀混合(图1),配制碘海醇浓度分别为2.5%、5%、10%、20%、40%的HA-I混合制剂各0.5ml,行CT扫描并测量CT值(南方医科大学研发PACS软件),观察碘海醇在混合制剂中是否均一分布,判断其是否能够反映HA的分布情况。

图1均匀混合后的HA-I制剂
Fig.1 HA and iohexol uniformly composited without ingredientsseparating.
1.2兔膝关节的药物注射
体重2.5kg左右的新西兰白兔若干,雌雄均可,无膝关节损伤和结构异常,由南方医科大学动物实验中心提供。3%戊巴比妥钠按1ml/kg从耳缘静脉注射麻醉成功后,膝关节备皮、皮肤消毒后,按照以下两种给药位点向膝关节腔注射HA-I制剂。
(1)髌骨下给药位点:双侧后肢自然伸直,以髌骨内侧中点为穿刺点,穿刺针与水平面呈15°~20°进入关节腔,针头到达髌骨中心下方,缓慢匀速注射HA-I混合制剂0.5ml。
(2)关节线给药位点:双侧后肢自然屈曲,以膝关节线内侧处为穿刺点,穿刺针垂直进入关节腔,针头到达股骨髁间窝前方,缓慢匀速注射HA-I混合制剂0.5ml。
1.3 CT扫描及三维重建
从关节线给药位点注射HA-I混合制剂完毕后立即行CT扫描(图2)。测量膝关节周围软组织、胫骨骨皮质、关节腔中HA-I混合制剂三者的CT值,并对图像进行三维重建。扫描参数:(1)图像采集设备,西门子SOMATOM Spirit 双源CT;(2)扫描条件,80KV,140KV,层厚0.8mm,窗宽1400,窗位300;(3)扫描范围,膝关节上下3cm,无间距连续扫描。
图2双源CT扫描
Fig. 2 Dual-source CT scanning
1.4 筛选HA-I混合制剂的最适宜碘海醇浓度
通过综合评估CT平扫与三维重建图像中药物分布与软组织及骨质的成像区分度,计算膝关节周围软组织、胫骨骨皮质、关节腔中HA-I制剂三者的平均CT值比值,筛选出能良好呈现药物在兔膝关节腔内成像分布的最适宜碘海醇浓度。
1.5 动态 X线透视及静态CT扫描观察
根据1.4实验结果,以5%碘海醇浓度的HA-I制剂作为示踪剂。在X线透视下,分别从髌骨下和关节线给药位点向兔膝关节腔注射HA-I制剂0.5ml,注射过程中动态观察HA在关节腔内的分布趋势。注射完毕后被动屈伸运动膝关节50次,随后立即行双源CT扫描。收集图像资料、三维重建后,分析比较两种给药位点下HA在膝关节腔的分布趋势与特征。
2结果
2.1 HA-I混合制剂均一性试验
HA-I混合制剂的CT扫描图像呈现均匀一致灰度,提示混合制剂能够客观反映HA的分布情况(图3)。

图3 HA-I混合制剂均一性试验
Fig.3 HA-iohexol composite uniformity test.
2.2软组织、骨质及不同碘海醇浓度混合制剂CT值比较
所有兔膝关节的周围软组织CT值范围波动于61.8±5.4~64.1±3.1Hu,胫骨骨皮质CT值范围波动于1380.6±8.6~1488.5±10.6Hu。关节腔内HA-I混合制剂CT值随碘海醇浓度增加而明显递增,并大致呈正比例关系;碘海醇浓度分别为2.5%、5%、10%、20%、40%时,膝关节软组织、HA-I制剂及骨组织三者的CT值对比值分别为2:7:46,2:14:44,2:28:44,2:60:46,2:98:45(表1,图4)。
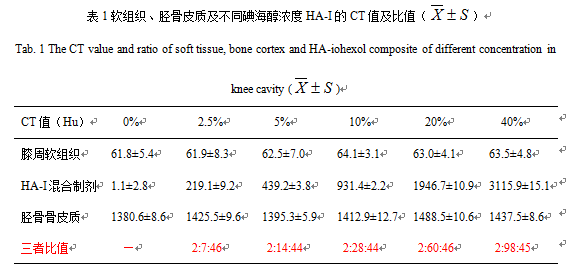
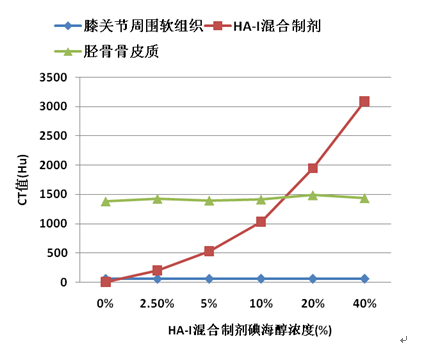
图4 软组织、胫骨皮质及不同碘海醇浓度HA-I混合制剂CT值的曲线图
Fig.4 The CT value of soft tissue, bone cortex andHA-iohexol composite in knee cavity treated with different concentration
2.3最佳示踪剂浓度筛选
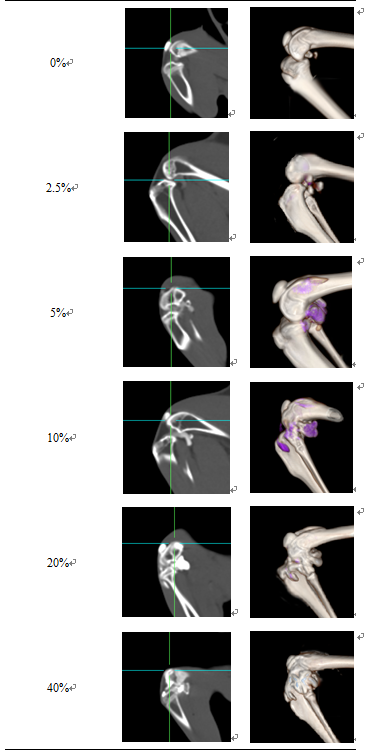
从CT平扫矢状位影像及三维重建图像可见(表2),碘海醇浓度为20%、40%时,显示为高密度影,无法与关节腔周围骨质区别;碘海醇浓度为2.5%时,因密度过低而无法观察;碘海醇浓度为5%、10%时,混合制剂密度与骨质能够良好区别,对比效果好,易于观察。
为最大限度保持药物原始性状,从而实现模型的最佳拟合性,最终选择5%碘海醇浓度的HA-I制剂进行药物示踪。
表2不同碘海醇浓度下膝关节CT平扫及三维重建效果
Tab. 2 Effect chart of CT plain scan and 3Dreconstruction treated with different concentration HA-iohexol

2.4 HA示踪模型的动态X线透视观察结果
X线透视结果直观显示出药物分布范围的差异,证实当前药物示踪模型的有效性。X线透视下,从髌骨下给药位点向兔膝关节注射HA-I制剂,可见药物主要向髌股关节分布(图5);从关节线给药位点注射,药物则主要向胫股关节分布(图6)。
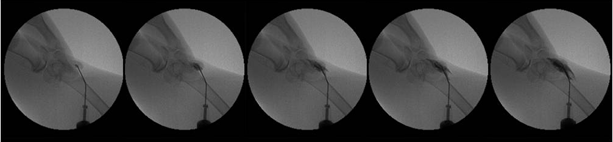
图5 X线透视下兔膝关节腔髌骨下给药的HA动态观察
Fig.5 Dynamic observation of HA administered through patellamedial approach via X-ray perspective
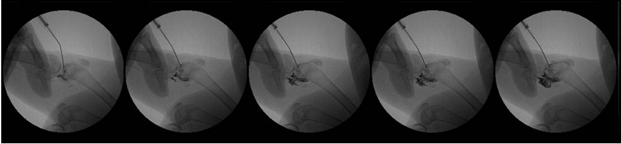
图6 X线透视下兔膝关节腔关节线给药的HA分布动态观察
Fig.6 Dynamic observation of HA administered through medialjoint line approach via X-ray perspective
2.5 HA示踪模型的CT平扫和三维重建观察结果
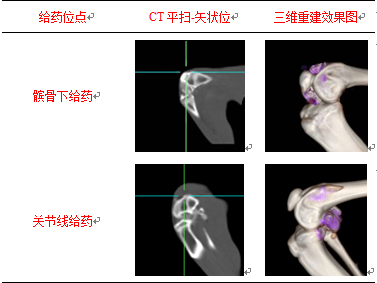
从CT平扫及三维重建结果可见,当前药物示踪模型可有效显示药物的分布范围,直观呈现不同给药位点带来的药物分布范围差异,进一步证实当前HA示踪模型的有效性。髌骨下给药的HA-I制剂主要分布于髌股关节及前关节腔;关节线给药的HA-I制剂则主要分布于胫股关节及后关节腔(表3)。
表3髌骨下给药及关节线给药的HA-I制剂在兔膝关节腔内分布的CT平扫及三维重建效果
Tab.3 Effect chart of CT plain scan and 3Dreconstruction of HA distribution administered through patellamedial approach and medial joint line approach
3.讨论
KOA以软骨损害和丢失为特征,损伤部位可能包括髌股关节、胫股关节内侧间隙及外侧间隙软骨等[6],不同的损伤部位对应不同的临床表现。临床工作中关节腔内注射HA治疗KOA包括髌骨下给药、关节线给药[7]等不同给药位点。值得关注的是,不同的给药位点,很可能导致HA在关节软骨表面的分布范围差异,进而造成疗效差异。因此,有必要观察不同给药位点相应的药物分布范围,为解决给药位点差异可能带来的疗效差异问题奠定基础。本实验以HA-I混合制剂[8]作为示踪剂,旨在探索一种通过CT扫描及X线透视观察HA在膝关节腔内分布情况的动物示踪模型。
HA为高分子聚合物,浓稠具有粘性,可溶于水;碘海醇属于非离子造影剂,其高密度特性使其在CT扫描及X线透视中清晰观察[9]。两者混合不产生化学反应,且均匀混合放置24小时以上未见成分分离。正由于碘海醇能与HA均匀混合,在CT及透视图像上观察到的碘海醇密度影像能够直观、间接反映HA在关节腔内的分布。
本实验并未参考常规造影检查中单纯采用碘海醇作为示踪剂,而选择HA与碘海醇混合这一示踪模式,原因在于:(1)碘海醇的CT值较高,在CT图像中呈现与骨质相似的高密度,不能很好与骨质区别,必须稀释至适合浓度以与骨质以及关节腔内软组织区别;(2)碘海醇本身为流质液体,弥散快,HA则质粘浓稠[10],碘海醇与HA混合后不但可被示踪观察,同时能够获得与HA相似的粘弹性,能够模拟HA在膝关节腔内的流动、扩散特点;(3)碘海醇获取容易且价格低廉,与HA均匀混合后即可使用,放置24小时仍维持均匀混合状态。本实验亦可选择其他非离子型造影剂如碘普罗胺、碘佛醇等代替碘海醇与HA混合。
由于混合制剂中碘海醇的浓度与CT平扫及三维重建质量优劣有密切关系,因此模型成功建立的关键在于筛选出最适宜示踪剂浓度。本研究发现,低水平碘海醇浓度(0%、2.5%)下,HA-I混合制剂CT值较低,与软组织相当,其平扫及三维图像丢失大量原有药物分布信息,无法完整呈现药物分布概况;在高水平碘海醇浓度(20%、40%)下,HA-I混合制剂CT值高于胫骨皮质CT值,其平扫图像中基本仍可识别药物密度影,但在三维重建中因成像重叠,无法区分骨质与药物分布影,失去实验观察意义。与低水平及高水平浓度相比,碘海醇浓度为5%和10%的HA-I制剂在基本保留HA原有物理特性基础上,其CT值介于周围软组织与骨质CT值之间,既完整保留原有药物分布信息,又满足三维重建区分识别度需要,避免与骨质和关节周围软组织的混淆,实现良好的呈现,可作为本模型的合适示踪剂浓度。
5%及10%碘海醇浓度的HA-I制剂均可提供药物与关节软组织、骨质之间的良好对比。考虑到实现模型的最佳拟合性,HA是本研究实验的观察对象,其质地稠,具有高粘弹性,而碘海醇则为流质液体,为最大限度保留HA的物理特性,从而更好地模拟HA在关节腔的实际分布趋势与特征,HA-I制剂的碘海醇浓度应尽量降低,因此本模型的最适宜示踪剂应为5%碘海醇浓度的HA-I制剂。
传统观点认为,不论从何种给药位点注射,HA进入膝关节腔后药物将向四周均匀扩散,可在膝关节各间室均匀分布。本研究实验中通过碘海醇示踪结合CT扫描及X线透视观察可见,不同给药位点注射HA-I制剂,可引起药物在膝关节腔的分布差异。髌骨下给药的HA主要分布于髌股关节,关节线给药的HA则主要分布于胫股关节,与传统观点相抵。目前所有关于评价HA治疗KOA疗效的临床研究均未说明给药位点,而不同临床研究的结果相互矛盾,这一实验结果可能为解释HA治疗KOA疗效争议提供思路。
需要指出,当前模型还存在一定局限性:(1)根据实验观察,活体兔膝关节腔中HA-I混合制剂在35-40分钟内会逐渐弥散、吸收,无法长时间动态观察药物的远期分布特征;(2)只能提供定性分布趋势,而未能获取定量分布数据。
总而言之,本研究以碘海醇浓度为5%的HA-I混合制剂作为示踪剂,结合CT扫描及X线透视技术成功构建了玻璃酸钠在兔膝关节腔内分布的示踪模型。通过CT断层影像,可以评估任意层面药物在兔膝关节腔内的定性分布,提供细节分布信息;通过三维重建成像,确立药物与关节腔的空间相对关系,提供宏观分布信息;X线透视则可提供药物的动态分布趋势信息。同时,本研究初步提示,给药位点差异可影响HA在膝关节腔内的分布。今后需进一步验证HA分布差异与其治疗KOA疗效差异的相关性。
参考文献
附:
第一作者
罗裕强,博士研究生,电话:13512776068,E-mail:kemanlaw@163.com
通讯作者:
史占军,主任医师,教授,博士生导师,E-mail:shizhanjun@yahoo.com
肖军,副主任医师,副教授,硕士生导师,E-mail:orthopaedxj@163.com
基金项目:
国家自然科学基金青年基金(编号81101389)
基金项目:国家自然科学基金青年基金(编号81101389)
作者简介:罗裕强,博士研究生,E-mail:kemanlaw@163.com,Tel:13512776068
作者单位:南方医科大学南方医院关节与骨病外科 510515 广州
通讯作者:史占军,主任医师,教授,博士生导师,E-mail:shizhanjun@yahoo.com
肖军,副主任医师,副教授,硕士生导师,E-mail:orthopaedxj@163.com


 京公网安备11010502051256号
京公网安备11010502051256号