给药位点差异对玻璃酸钠在膝关节软骨表面覆盖范围的影响
2015-01-29 作者:罗裕强,唐元,贾梦岩,蔡忠江,史占军,肖军 点击量:1384 我要说
罗裕强 唐元 贾梦岩 蔡忠江 史占军* 肖军*
南方医科大学南方医院关节与骨病外科 广州 中国 510515
【摘要】目的 观察给药位点差异对玻璃酸钠(HA)在膝关节软骨表面覆盖范围的影响,为优化HA给药途径奠定基础。方法 膝关节大体标本32例,按股骨髁宽最接近匹配原则随机分为髌骨下给药组和关节线给药组。以5%亚甲蓝示踪的HA注射液2.5ml注射完成后将膝关节大体标本固定于Electro-Force平台作5~45°反复屈伸运动,2小时后切开关节腔观察HA在膝关节软骨表面的覆盖范围。将膝关节表面分为8个区域,按照HA在各区域的覆盖面积赋分,记录HA在膝关节表面各区域的到达范围。统计学对比分析不同给药位点对HA在膝关节表面覆盖范围的影响,揭示HA分布特征与给药位点和股骨髁宽的相关性。结果 股骨髁宽≤7.5cm时,髌骨下给药组在胫骨平台外侧区的药物覆盖评分低于关节线给药组(P=0.017),其它各区域无组间统计学差异。股骨髁宽>7.5cm时,髌骨下给药组在髌骨区、滑车区的药物覆盖评分显著高于关节线给药组(P=0.001,0.001),在股骨外髁前区、股骨内髁后区、股骨外髁后区和胫骨平台外侧区的药物覆盖评分则显著低于关节线给药组(P=0.005,0.006,0.001,0.000)。结论 从不同位点给药,HA在小体型(股骨髁宽≤7.5cm)人群膝关节腔内具有相似的分布特征,但是,在大体型(股骨髁宽>7.5cm)人群膝关节腔内的分布则显著不同。股骨髁宽>7.5cm时,髌骨下给药的HA主要分布于髌股关节及前关节腔;关节线给药的HA则主要分布于胫股关节及后关节腔。髌骨下给药途径可能更适合于髌股关节骨关节炎,关节线给药途径更适合于胫股关节骨关节炎。
【关键词】玻璃酸钠;股骨髁宽;髌股关节;胫股关节;骨关节炎
Injection Site DiversityInfluence Sodium Hyaluronate Distribution on Knee Cartilage Surface: ACadaveric Study
LUO Yu-qiang, TANG Yuan, JIA Meng-yan,CAI Zhong-jiang, SHI Zhan-jun, XIAO Jun*
Department of Joint Surgery, NanfangHospital, Southern Medical University,
Guangzhou 510515, China
【Abstract】Objective To elucidate whether and howinjection site diversity influences on the sodium hyaluronate(HA) distribution on cartilage surface of the knee joint. Methods Thirty-Two human cadaveric kneeswere randomly divided into group Ⅰ and group Ⅱ with roughly matched femoral condyle width (FCW). Kneesof group Ⅰ were injectedwith a 2.5ml HA through the patella medial approachand group Ⅱthrough the medial joint lineapproach interfused with a 5% methylene blue tracer.Each specimen was then simulated a 5~45 degree alternatingwalking for 2h in the Electro-Forceplatform. Afterwards, all the knee cavities were cut open to show the range ofHA distribution. Based on the eight-zoning classification law for the kneecartilage surface, the coverage area of HA in eachzone was scored and the characteristics of HA distribution was depicted, aswell as HA zonal distribution diversity between groups were statisticallyanalyzed. Results HA showedanalogical distribution in all zones except the lateral tibial plateau (P=0.017) at the time of FCW ≤ 7.5cm. However, HAcoverage showed significantly higher distributionscores in the patella zone and the femoral trochlearzone (P=0.001 and 0.001respectively) but significant lower distribution scores in the antero-lateral/postero-lateral femoral condyle, the medialposterior femoral condyle zone and the lateral tibial plateau zone (P=0.005, 0.006,0.001 and 0.000 respectively) at the time of FCW> 7.5cm. ConclusionWhen delivered through different injection approaches, HA showed analogicaldistribution characteristics in most zones of the knee cavity in populationwith a small bodily shape (FCW ≤ 7.5cm), but significant diverse distributioncharacteristics in population with a big bodily shape (FCW >7.5cm). When FCW> 7.5cm, HA injected through the medial-patellar approach tended to bedistributed mainly over the patella-femoral articulation and the anterior kneecavity. Whereas HA injected through the joint line approach tended to bedistributed mainly over the tibio-femoral articulation and the posterior kneecavity. These findings suggest the medial-patellar approach may be a preferentialHA delivery approach for the patella-femoral osteoarthritis and the joint lineapproach more advantageous for the tibio-femoral osteoarthritis.
【Key words】Sodiumhyaluronate; Femoral condyle width; Patella-femoral articulation; Tibo-femoralarticulation; Osteoarthritis
膝关节骨关节炎(KneeOsteoarthritis,KOA)是一种以软骨退变和磨损为特征的常见疾病。研究发现:KOA患者的内源性玻璃酸钠(HyaluronicAcid,HA)分子高级结构缺失,关节液粘滞度降低,软骨失去润滑和保护[1],是KOA的发病核心机理之一。理论上,关节腔注射外源性HA,可望补充内源性HA不足,发挥治疗效应[2]。大量临床研究发现HA可缓解KOA症状并改善膝关节功能[3, 4]。但是,也有部分临床研究认为膝关节腔内注射外源性HA缺乏临床疗效[5]。
观点对立,原因何在?回顾发现,所有关于HA的临床研究均未说明给药位点----不同给药位点是否会造成HA在膝关节腔内分布范围的差异?----是否因为给药位点导致HA无法实现病灶覆盖,影响了HA对KOA的疗效,最终引起结果偏歧与研究结论对立?有鉴于此,本实验拟通过大体实验[6]直接观察不同给药位点给药后HA在膝关节软骨表面的分布范围。研究旨在明确给药位点是否对HA在膝关节腔内的分布范围造成影响,进而探索最有利于药物在病灶局部覆盖的给药位点,为提高HA的疗效奠定基础。
1材料与方法
1.1样本分组
关节囊完整的中国南方地区膝关节大体标本32例,X线后前位测量股骨髁宽后,按照股骨髁宽最接近的匹配原则,随机分为髌骨下给药组(n=16)和关节线给药组(n=16)。所有膝关节截取髌骨上和胫骨结节下方10cm范围后以牙托粉包埋,备模拟步行实验使用。
1.2 HA-亚甲蓝混合制剂的制备与稳定性评价
每支HA注射液(佰备,上海景峰制药股份有限公司,2.5ml:25mg)2.5ml加入75μL5%亚甲蓝,均匀混合。分别静置0h、3h、6h和12h,观察混合制剂是否存在组分分离现象,判断亚甲蓝是否能够客观显示HA的到达位置。
1.3 HA给药方法[7]
按照经典的膝关节注射方法,分别选择髌骨内侧给药途径和胫股内侧关节线给药途径,据此分为髌骨下给药组和关节线给药组。
髌骨下给药组注射方法:膝关节取自然伸直状态,以髌骨内侧中点为穿刺点,注射器与水平面呈15°~20°进入关节腔,针头到达髌骨中心下方(图1A),缓慢匀速注射HA-亚甲蓝制剂2.5ml。
关节线给药组注射方法:膝关节取90°屈曲状态,以髌骨内侧缘与下极连线交点为穿刺点,注射器垂直进入关节腔,针头到达股骨内侧髁内侧缘(图1B),缓慢匀速注射HA-亚甲蓝制剂2.5ml。

A 髌骨下给药途径 B关节线给药途径
图1髌骨下给药与关节线给药示意图
1.4 步行模拟实验
HA-亚甲蓝制剂注射完成后,将膝关节大体标本立即固定于Electro-Force生物力学装置(Bose Corporation Electro-Force Systems Group),驱动膝关节大体标本进行5~45°的反复屈伸,按照45循环/min的速率模拟膝关节行走运动2小时(图2)。

图2 Electro Force测试平台
对WORMS(WholeOrgan Magnetic Resonance Imaging Score)膝关节表面分区法[8] 进行改良,形成“膝关节表面8分区法”(表1):(1)髌骨区;(2)股骨滑车区,股骨髁间穹窿与股骨内、外髁最高缘所围成梯形区域;(3)股骨内侧髁前区,内侧半月板后角关节囊附着部位以前、内侧髁最高缘以外所围成区域;(4)股骨外侧髁前区,外侧半月板后角关节囊附着部位以前、外侧髁最高缘以外所围成区域;(5)股骨内侧髁后区,内侧半月板后角关节囊附着部位以后区域;(6)股骨外侧髁后区,外侧半月板后角关节囊附着部位以后区域;(7)胫骨平台内侧区,无软骨覆盖区以内区域;(8)胫骨平台外侧区,无软骨覆盖区以外区域。
表1膝关节表面8分区法
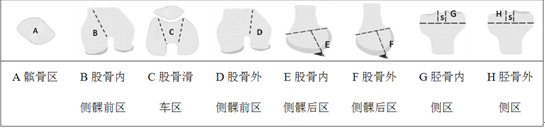
注:s区为无软骨覆盖区
1.6药物覆盖范围赋分
按特定分区范围内被HA-亚甲蓝制剂所染色的面积占该区域总面积的比例进行等级评定(表2):(1)分,染色面积<区域总面积的1/5;(2)1分,染色面积占区域总面积的1/5~2/5;(3)2分,染色面积占区域总面积的2/5~3/5;(4)3分,染色面积占区域总面积的3/5~4/5;(5)4分,染色面积>区域总面积的4/5。
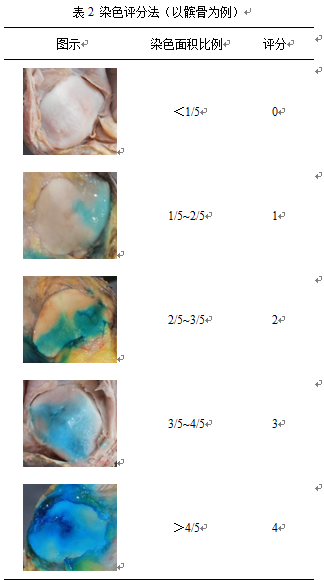
1.7 HA药物分布区域分析
对于每个软骨表面分区,以股骨髁宽为横坐标、药物覆盖评分为纵坐标,绘制散点图。观察不同给药位点HA在膝关节表面不同区域的药物覆盖范围差异,了解不同给药位点分组对应药物分布范围与股骨髁宽的相关性趋势。
1.8 亚组分组和统计学分析
根据不同股骨髁宽和药物在各区域分布特征,发现以股骨髁宽7.5cm为分界点,HA在关节各区域的分布特征呈现差异。因此,进一步将样本分成股骨髁宽≤7.5cm的小体型膝关节亚组和股骨髁宽>7.5cm的大体型膝关节亚组。
对于小体型和大体型膝关节亚组,分别应用Mann-Whitney检验对比HA在不同给药位点下各膝关节表面区域的药物覆盖评分差异。同时,应用秩相关检验法分析HA在亚组间存在分布差异膝关节表面区域的药物覆盖评分与股骨髁宽的相关性。
相关系数绝对值>0.7为具有较好相关性,统计学差异的界定取值P<0.05。
2结果
2.1 HA-亚甲蓝混合制剂稳定性试验
HA-亚甲蓝制剂于室温分别静置3h、6h和12h未见组分分离现象,提示混合制剂能够客观反映HA的到达位置(图3)。

图3 HA-亚甲蓝混合制剂稳定性试验
2.2 不同股骨髁宽膝关节的HA药物覆盖范围
两给药途径组在膝关节表面的药物覆盖范围评分散点图如下(图4)。当股骨髁宽≤7.5cm时,除胫骨平台外侧区以外,两组对应的HA药物分布区域散点连线呈现粘合现象,当髁宽>7.5cm时,髌骨区、股骨滑车区、股骨外髁前区、股骨内髁后区、股骨外髁后区、胫骨平台外侧区的药物分布区域散点连线开始出现明显的分离现象。以上结果提示HA在膝关节表面的分布范围可能受到膝关节大小(股骨髁宽)的影响。
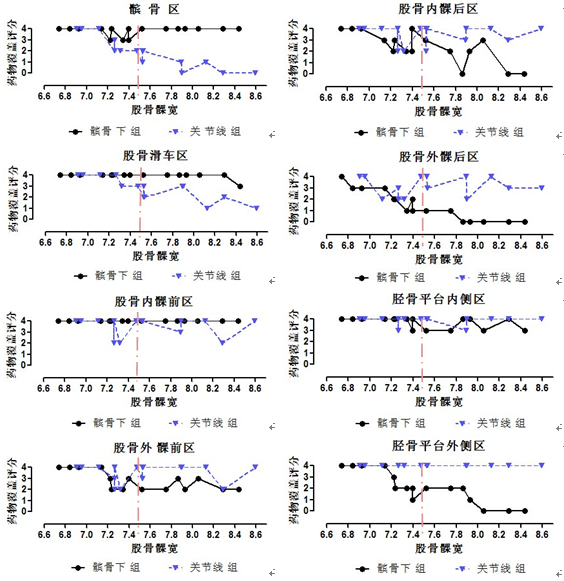
图4两给药途径组在各软骨表面分区的股骨髁宽-药物覆盖评分散点图
据此,进一步将每组样本分为股骨髁宽≤7.5cm的小体型膝关节亚组和股骨髁宽>7.5cm的大体型膝关节亚组,分析HA药物覆盖范围与股骨髁宽的相关性。
2.3 小体型膝关节HA药物覆盖范围的差异
对于小体型膝关节亚组,关节线给药组在胫骨平台外侧区的药物覆盖评分高于髌骨下给药组,差异具备统计学意义(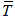 =11.50 vs 6.78,P=0.017),其余各分区药物覆盖评分无统计学差异(图5,表3)。
=11.50 vs 6.78,P=0.017),其余各分区药物覆盖评分无统计学差异(图5,表3)。
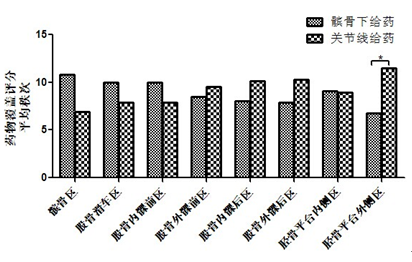
图5 小体型膝关节不同给药途径对应药物覆盖范围评分对比
2.4 大体型膝关节HA药物覆盖范围的差异
对于大体型膝关节亚组,髌骨下给药组与关节线给药组在髌骨区、股骨滑车区、股骨外髁前区、股骨内髁后区、股骨外髁后区、胫骨平台外侧区的染色评分有统计学差异,在髌骨区、股骨滑车区其覆盖评分髌骨下给药组显著高于关节线给药组(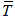 =12.00 vs 4.50,P=0.001;
=12.00 vs 4.50,P=0.001;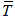 =11.79 vs 4.69,P=0.001),在股骨外髁前区、股骨内髁后区、股骨外髁后区、胫骨平台外侧区其药物覆盖评分则显著低于关节线给药组(
=11.79 vs 4.69,P=0.001),在股骨外髁前区、股骨内髁后区、股骨外髁后区、胫骨平台外侧区其药物覆盖评分则显著低于关节线给药组(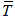 =10.81 vs 4.79,P=0.005;
=10.81 vs 4.79,P=0.005;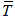 =10.88 vs 4.71,P=0.006;
=10.88 vs 4.71,P=0.006;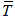 =11.50 vs 4.00,P=0.001;
=11.50 vs 4.00,P=0.001;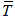 =11.50 vs 4.00,P=0.000)(图6,表3)。
=11.50 vs 4.00,P=0.000)(图6,表3)。
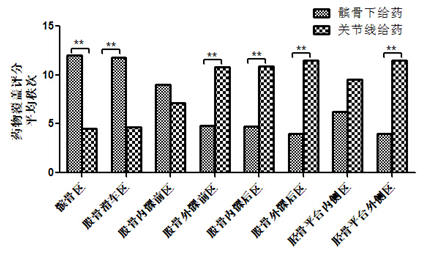
图6大体型膝关节不同给药途径对应药物覆盖范围评分对比
表3 两给药途径组大、小体型膝关节药物覆盖评分对比的秩和检验(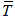 ,n=32)
,n=32)
分组 | 髌骨区 | 股骨滑车区 | 股骨内髁前区 | 股骨外髁前区 | 股骨内髁后区 | 股骨外髁后区 | 胫骨平台内侧 | 胫骨平台外侧 |
小体型组 |
|
|
|
|
|
|
|
|
髌骨下 (n=9) | 10.83 | 10.00 | 10.00 | 8.50 | 8.00 | 7.89 | 9.06 | 6.78 |
关节线 (n=8) | 6.94 | 7.88 | 7.88 | 9.56 | 10.13 | 10.25 | 8.94 | 11.50 |
Z值 | -1.744 | -1.549 | -1.549 | -0.476 | -0.986 | -1.011 | -0.086 | -2.397 |
P值 | 0.081NS | 0.121NS | 0.121 NS | 0.634 NS | 0.324 NS | 0.312 NS | 0.931 NS | 0.017* |
大体型组 |
|
|
|
|
|
|
|
|
髌骨下- (n=7) | 12.00 | 11.79 | 9.00 | 4.79 | 4.71 | 4.00 | 6.21 | 4.00 |
关节线 (n=8) | 4.50 | 4.69 | 7.13 | 10.81 | 10.88 | 11.50 | 9.56 | 11.50 |
Z值 | -3.447 | -3.214 | -1.369 | -2.795 | -2.757 | -3.347 | -1.768 | -3.545 |
P值 | 0.001** | 0.001** | 0.171 NS | 0.005** | 0.006** | 0.001** | 0.077NS | 0.000** |
注:NS为P>0.05,*为P<0.05,**为P<0.01
2.5 小体型和大体型膝关节在关节表面各区域分布差异的大体观察
可见,对于不同大小的膝关节,不同给药位点的HA在膝关节软骨表面呈现截然不同的药物分布特征。以股骨髁宽衡量膝关节大小,当股骨髁宽≤7.5cm时,不同给药途径对应的HA药物分布范围大致类似(唯一差异区域位于胫骨平台外侧区);但是,当股骨髁宽>7.5cm时,多个区域出现药物分布差异----髌骨下给药时,HA药物分布主要分布于髌股关节及前关节腔,而关节线给药则主要分布于胫骨关节及后关节腔(表4)。
表4不同给药位点/不同体型的膝关节HA药物分布情况
2.6 HA药物覆盖范围与股骨髁宽的相关性
进一步探讨HA在膝关节软骨表面分布范围与体型大小(股骨髁宽)的相关性。相关性分析结果显示:体型越大,不同给药位点的HA分布差异越明显;体型越小,差异越不显著。
对于小体型膝关节,在胫骨平台外侧区,髌骨下给药组的股骨髁宽与药物覆盖评分有负相关关系(r=-0.940,P=0.000),相关系数绝对值>0.7且具有统计学意义,关节线给药组的股骨髁宽与药物覆盖评分无相关关系(表5)。
表5小体型膝关节各分区药物覆盖评分与股骨髁宽的秩相关分析
| 髌骨区 | 股骨滑车区 | 股骨内髁前区 | 股骨外髁前区 | 股骨内髁后区 | 股骨外髁后区 | 胫骨平台内侧 | 胫骨平台外侧 |
髌骨下(n=9) |
|
|
|
|
|
|
|
|
相关系数r | -0.548 | Null | Null | -0.757 | -0.490 | -0.918 | -0.411 | -0.940 |
P值 | 0.127NS | Null | Null | 0.018* | 0.181NS | 0.000** | 0.272 NS | 0.000** |
关节线(n=8) |
|
|
|
|
|
|
|
|
相关系数r | -0.886 | -0.549 | -0.317 | -0.311 | -0.317 | -0.295 | 0.000 | Null |
P值 | 0.003** | 0.159NS | 0.444 NS | 0.453 NS | 0.444NS | 0.478NS | 1.000 NS | Null |
注:NS为P>0.05,*为P<0.05,**为P<0.01
对于大体型膝关节,在髌骨区,髌骨下给药组的股骨髁宽与药物覆盖评分无相关关系,关节线给药组则呈现负相关关系,相关系数绝对值>0.7且具有统计学意义(r=-0.743,P=0.035);在股骨滑车区、股骨外髁前区、股骨内髁后区,髌骨下给药组与关节线给药组的股骨髁宽与药物覆盖评分均无相关关系;在股骨外髁后区、胫骨平台外侧区,髌骨下给药组的股骨髁宽与药物覆盖评分有负相关关系,相关系数绝对值均>0.7且具有统计学意义(r=-0.791,P=0.034;r=-0.926,P=0.003),关节线给药组则无相关关系(表6)。
表6 两给药途径组大体型膝关节各分区药物覆盖评分与股骨髁宽的秩相关分析
| 髌骨区 | 股骨滑车区 | 股骨内髁前区 | 股骨外髁前区 | 股骨内髁后区 | 股骨外髁后区 | 胫骨平台内侧 | 胫骨平台外侧 |
髌骨下(n=7) |
|
|
|
|
|
|
|
|
相关系数r | Null | -0.612 | Null | 0.000 | -0.529 | -0.791 | 0.144 | -0.926 |
P值 | Null | 0.144NS | Null | 1.000 | 0.222NS | 0.034* | 0.758NS | 0.003** |
关节线(n=8) |
|
|
|
|
|
|
|
|
相关系数r | -0.743 | -0.504 | -0.296 | 0.031 | 0.151 | -0.483 | 0.082 | Null |
P值 | 0.035* | 0.203NS | 0.476NS | 0.942NS | 0.721NS | 0.226NS | 0.846 NS | Null |
注:NS为P>0.05,*为P<0.05,**为P<0.01
3讨论
KOA是一种以软骨损伤及关节腔微环境紊乱为特征的疾病[9]。HA治疗KOA的机制包括:(1)调节关节内组织、关节滑液以及关节软骨之间的营养与代谢,调节关节内软组织中细胞内基质的合成,增强成纤维细胞与滑膜细胞活性[10]:(2)恢复关节滑液粘弹性,起到物理润滑、吸收应力、减少摩擦的作用[11];(3)遮蔽终末段疼痛神经纤维的受体,从而减少疼痛传导而产生镇痛作用等[12];(4)外源性HA结合CD44受体从而刺激相应部位滑膜细胞生成内源性HA,弥补内源性HA的数量和结构缺陷,发挥治疗效应[13]。
虽然理论上,HA对KOA必定存在疗效,但不同文献针对HA治疗KOA的疗效结论迥异,观点尖锐对立。Ishijima M等[14]及Leighton R等[15]指出HA治疗KOA疗效与NSAIDs类药物及激素封闭相当,镇痛效应卓越,同时具备更佳的安全性;HuangTL等[16]一项纳入200例亚洲KOA患者的临床试验指出,HA可持久缓解疼痛症状并改善膝关节功能。但Rutjes AW等[17]在一项系统评价中则认为HA治疗KOA并无显著临床疗效,反而带来相关严重不良反应;Kul-PanzaE等[18]也指出HA在KOA患者症状与膝关节功能改善方面疗效与安慰剂无异。
到底HA是否具备KOA治疗效应?同为大型临床研究,为何出现观点对立现象?回顾文献发现,以上所有临床研究均未标注HA的给药位点。传统观点认为:HA经皮穿刺进入膝关节腔后,膝关节各间室相互交通,从不同位点进入关节腔内的HA经过膝关节活动,药物将向四周均匀扩散,可在膝关节各间室和软骨表面各个区域的均匀分布。在这一传统“默认”观点的基础上,研究者普遍不考虑给药位点对临床研究结果带来的偏歧,臆断随着膝关节的运动可实现HA均匀分布,给药位点差异对KOA疗效不会产生影响。
事实上,这一“默认”观点缺乏证据支持。根据文献回顾结果,罕见有关HA给药位点差异对KOA疗效影响的临床及基础研究。仅Jackson DW等[19]比较了膝关节前内侧、膝关节前外侧、髌骨旁三种给药途径的首次针头置入关节腔成功率(前外侧为71%,前内侧为75%,髌骨旁为93%),其研究也仅仅旨在避免HA注入髌下脂肪垫或滑膜组织造成的疗效下降或患者不适感,并非关注药物在关节腔内的分布特征。迄今为止,尚无关于HA在膝关节软骨表面分布范围的研究报道。
基于HA发挥疗效的作用机理,HA必须实现对病变软骨区域的覆盖,才能最大限度发挥表面润滑、软骨保护,甚至软骨修复效应。但如果从某一既定的位点给药,药物并不能到达特定的软骨病变区域,则必定严重削减药物疗效的发挥。值得关注的是,至今这一问题恰恰被“所有”临床研究所忽略。KOA实际上是髌股关节OA、内侧胫股关节OA及外侧胫股关节OA的总称[20]。如果药物仅仅分布于胫股关节面,若KOA主要症状源于髌股关节时,在HA药物无法到达前提下,HA治疗KOA的疗效必定大打折扣,甚至缺如。可以推断,对给药位点影响药物分布范围这一问题的忽略,造成HA给药位点混乱,进而导致无法保障药物到达病灶软骨区域,很可能是引起这些临床研究结果偏歧的关键原因。
因此,本研究聚焦于不同给药位点对HA在关节软骨表面分布范围的影响。实验结果发现:HA通过不同的给药位点进入关节腔后,其药物分布根据给药位点和膝关节大小的的差异,存在明显的不同。当膝关节股骨髁宽≤7.5cm时,髌骨下给药与关节线给药途径下HA的分布在膝关节腔内绝大部分区域无统计学差异(胫骨平台外侧区除外);当膝关节股骨髁宽>7.5cm时,髌骨下给药与关节线给药途径下HA的分布在髌骨区、股骨滑车区、股骨外髁前区、股骨内髁后区、股骨外髁后区、胫骨平台外侧区有统计学差异。
可见,对于临床最常使用的2.5ml剂量HA,不论通过哪种位点给药,HA制剂都不能实现对全部关节软骨表面的完整覆盖。给药位点差异对药物分布特征的影响,以股骨髁宽7.5cm为界出现显著差异。而且,这种差异随着膝关节体型的增大而趋于更加明显。以股骨髁宽为判断膝关节体型大小的简易标准,当膝关节股骨髁宽≤7.5cm时,髌骨下给药与关节线给药的HA分布基本相似;当股骨髁宽>7.5cm时,髌骨下给药与关节线给药的HA分布差异随膝关节体型增大而递增。从髌骨下给药的HA更倾向分布于髌股关节和前关节腔,而从关节线给药的HA更倾向分布于胫股关节和后关节腔。
因此,为了保证HA经皮穿刺注射入膝关节腔后,能够到达病灶软骨区域,在不改变HA剂量的前提下,应该根据膝关节体型大小和软骨病损所在位置选择最合适的给药位点。当患者膝关节体型较小(股骨髁宽≤7.5cm)时,无论对于髌股关节KOA还是胫股关节KOA,可根据操作者的个人习惯随机选择成功率较高的给药途径;但当患者膝关节体型较大(股骨髁宽>7.5cm)时,对于髌股关节受损为主的KOA,应该优先选择髌骨下给药途径,而对于胫股关节受损为主的KOA,则应该优先选择关节线给药途径。
综上所述,本研究通过大体实验观察给药位点差异对HA在膝关节软骨表面分布范围的影响,纠正了被广泛接受的“HA通过关节运动获得均匀分布”和“给药位点对HA分布不构成影响”的传统“默认”观点。在关节行走运动的基础上,无论选择何种给药位点,2.5ml剂量的HA都无法实现在膝关节腔内的均匀分布。给药位点对HA在膝关节表面分布的影响根据膝关节体型大小存在差异:当股骨髁宽≤7.5cm时,两种给药途径下HA有相似的药物分布特征;当股骨髁宽>7.5cm时,从髌骨下给药HA主要分布于髌股关节和前关节腔;从关节线给药则主要分布于胫股关节和后关节腔。基于HA的作用机制,髌骨下给药途径可能更适合于髌骨软化症及髌股关节KOA,关节线给药途径更适合于胫股关节KOA。
参考文献
基金项目:国家自然科学基金青年基金(81101389);广东省自然科学基金博士启动项目(S2011040003467)
作者简介:罗裕强,博士研究生,E-mail:kemanlaw@163.com,Tel:13512776068
作者单位:510515 广州,南方医科大学南方医院关节与骨病外科
通讯作者:史占军,主任医师,教授,博士生导师,E-mail:shizhanjun@yahoo.com
肖军,副主任医师,副教授,E-mail:orthopaedxj@163.com


 京公网安备11010502051256号
京公网安备11010502051256号