平山病真的只累及“下”运动神经元吗?—— 平山病患者比目鱼肌H反射的变化与动态磁共振成像异常相关性研究
2021-02-25 文章来源:复旦大学附属华山医院 美国上州大学医学院 我要说
平山病真的只累及“下”运动神经元吗?
——平山病患者比目鱼肌H反射的变化与动态磁共振成像异常相关性研究
郑超君a 朱愈b 吕飞舟a 朱冬青a 杨硕a 马晓生a 夏新雷a Robert Weberb 姜建元a
a.复旦大学附属华山医院
b.美国上州大学医学院
关键信息
1. 随着疾病进展,平山病患者可能发生颈脊髓损伤。
2. 上运动神经元病变更可能发生在有严重颈部屈曲异常的平山病病例中。
3. 随着疾病进展,颈脊髓可能会进一步向前移位,这表明平山病可能不是一种自限性疾病。
摘要
目的 探讨平山病患者比目鱼肌H反射的变化,并分析这些变化与颈屈曲时颈脊髓前移的相关性。
方法 记录81例平山病患者和34例对照组双侧跟腱振动及不振动时比目鱼肌H反射波幅,测定振动抑制指数(vibratory inhibition index, VII)和Hmax/ Mmax比值。使用动态磁共振成像测量所有平山病患者屈曲时颈脊髓的最大前移位程度。
结果 6/81例(7.4%)平山病患者VII明显升高,其中5例Hmax/Mmax比值异常。与病程相比(r=0.29~0.36, P<0.05),颈脊髓最大前移度与VII和Hmax/Mmax比值相关性更强(r=0.51~0.81, P<0.05)。
结论 平山病患者在疾病进展过程中可能会发生颈脊髓损伤,且这些病变更可能发生在较严重的颈椎屈曲结构异常的病例中。有些患者在平山病早期即可出现颈脊髓损伤。
意义 对于有严重颈椎屈曲异常的平山病患者,由于可能早期即发生上运动神经元病变,应更加谨慎。
关键词 平山病、颈脊髓损伤、比目鱼肌H反射试验、振动抑制指数、动态磁共振成像、颈脊髓前移位
1 引言
平山病(Hirayama disease, HD)最早于1959年由日本学者平山惠造[9]报道。平山病的病因仍有争议。目前,其主要机制是颈椎屈曲时脊髓前动脉区域的微循环紊乱引起的慢性颈脊髓缺血[2,7]。脊髓前角细胞对缺血性损伤尤其敏感,而且之前的平山病尸检病例显示颈脊髓前角和腹侧神经根区域都有局限性坏死[10]。
平山病被认为是一种只涉及下运动神经元(lower motor neurons, LMN)的神经疾病(例如前角细胞和腹侧神经根)[2]。然而,Zhou等人和Wang等人都发现,约2.7-6.3%的平山病患者存在明显的下肢反射亢进,与上运动神经元(upper motor neurons, UMN)水平的病变相一致[28,33]。在我们之前的研究中也报道过类似的情况[29-30]。此外,最近的病例报告显示,一些平山病患者可能随着疾病进展而出现明显的长束体征[18,23]。所有这些结果表明,由颈部屈曲引起的持续微循环障碍可能同时导致脊髓前动脉分水岭区皮质脊髓束异常。
Hoffmann首先描述了H反射,它是通过电刺激低阈值Ia肌梭传入神经,从而激活α运动神经元而诱发的[5]。H反射为单突触反射,因此可用于评估控制节段性运动兴奋性的下行皮质脊髓束功能[24]。既往研究表明UMN病变患者振动时对H反射的抑制显著降低,而比目鱼肌H反射最大反应与肌肉电位的比值(Hmax/Mmax)明显增大[16,21,27]。
本研究中,我们使用比目鱼肌H反射试验(Hmax/Mmax比值和H反射的振动抑制指数)定量评价平山病患者的皮质脊髓束功能。此外,还分析了皮质-脊髓束功能与病程、临床特征和颈脊髓向前移位的相关性。
2 方法
2.1患者信息
本研究包括81名平山病患者和34名年龄和性别匹配的健康受试者。所有患者于2011年10月至2017年2月在华山医院招募。此项目通过了华山医院伦理委员会的审核,每位受试者均签署知情同意书。患者组的34名受试者使用的测试方法与我们之前的研究方法完全不同,研究目的也不同,在本研究中没有重复以往报道的主要结果[30-31]。
对照组包括肌力、感觉功能、深部腱反射在内的神经系统检查结果均正常。接受过颈椎手术的受试者以及当前或过去表现出颈神经根病变、臂丛损伤、腕管综合征、周围神经病变、肌肉营养不良、糖尿病或周围血管疾病的受试者被排除在对照组之外[29,31]。
平山病的诊断标准为[29,31]:
(1)25岁之前隐匿性起病;
(2)上肢远端单侧或双侧不对称性肌无力和肌萎缩,不伴有感觉功能或下肢受累,电生理检查可发现局限于单侧或双侧上肢的失神经支配,不伴有感觉神经异常;
(3)伴或不伴寒冷麻痹、肌束震颤和伸指震颤等临床症状;
(4)颈椎屈曲磁共振成像(MRI)显示由于后方硬膜前移和硬膜后新月形异常影导致的颈脊髓受压。
平山病的排除标准为[29,31]:
(1)脊髓灰质炎、脊髓肿瘤或颈椎异常病史;
(2)局灶性或多局灶性神经病变;
(3)臂丛神经损伤;
(4)先天性肌肉萎缩症;
(5)颈椎病肌萎缩症;
(6)原发性或伴发神经肌肉连接处疾病;
(7)伴发创伤、炎症或感染。
2.2测试方法
纪录过程中,所有受试者取俯卧位,在踝关节下放置枕头,膝盖轻度弯曲120度,踝关节弯曲110度,以使比目鱼肌充分放松,避免踝关节位置的改变[14]。我们通过一个简短的演示向受试者说明测试标准,以确保所有受试者在进行测试前都熟悉设备和测试流程。
用表面电极刺激腘窝处胫神经,在比目鱼肌上记录双侧H反射(Sol H-reflex)(图1A)。为了电刺激胫神经,我们通过直径为0.3cm的圆形电极施加1.0ms单相脉冲。每10秒进行一次刺激。调整刺激电极位置以获得引起H反射的最低阈值。调整刺激强度以引出每个被测试肌肉的最大H反射波幅。利用表面电极记录比目鱼肌的最大复合肌肉动作电位(CMAP)。记录电极置于双侧比目鱼肌肌腹处(腓肠肌内外侧头分叉下两横指),参考电极置于跟腱沿线距离记录电极远端约3cm处,接地电极置于刺激器与记录电极之间(图1A)。

图1.一位16岁的男性平山病患者,记录H反射对胫骨神经的刺激,并在其两侧应用振动器
聚焦振动器和电极的位移如图所示:(A)随着刺激强度的增加,H反射波幅在两侧明显降低(B and B’),症状较重侧Hmax/Mmax比值;(B)较症状较轻侧Hmax/Mmax比值(B’)显著升高,与症症状较轻侧(C’)相比,在症状侧跟腱振动时记录到H反射VII度更高(C)。S:刺激器,G:接地电极,R:记录电极,V:振动器,M:M波,H:H反射,*:最大h反射波幅,**:最大M波波幅。Hmax/Mmax比值:平均最大H反射波幅/平均最大M波波幅
2.2.1 Hmax/Mmax比值和H反射
已经证实,随着刺激强度的增加,H反射波幅存在经典的周期性变化[14](图1)。得到引发最大H反射时的刺激强度,用相同的刺激强度连续记录5次,计算平均最大H反射波幅(Hmax)。得到引发最大M波波幅的强度的刺激强度,用相同的刺激强度连续记录5次计算平均最大M波波幅(Mmax)。然后计算得出Hmax/Mmax比值。
2.2.2 H反射振动抑制指数
使用手持式振动器(Shuang Quan SQ-B08, Wenzhou, China; frequency:50Hz)于被测踝关节的跟腱处振动300秒,电刺激强度与之前用于激发最大H反射时相同(图1A)[15]。然后在振动过程中连续测量5个H反射波幅,以得出平均H反射波幅(Hvib)。H反射振动抑制指数(VII)的计算公式为:(Hvib/Hmax)*100%。
当Hmax/Mmax比值和VII指数均高于对照组平均值2个标准差(SDs)时,平山病患者的测量结果被判定为异常。所有的电生理测试过程均使用基于计算机的EMG设备(Nihon Kohden MEB-9400, Japan),并均在皮温超过32℃的条件下进行。
2.2.3在动态MR中获得的结果
平山病患者均行颈椎自然位和屈颈位MRI。行屈颈位MRI时,常规使用木制三角形枕来保持颈部屈曲[29],根据先前的研究,这种姿势所引起的颈部屈曲的程度足以使后硬膜囊产生适当的前移位[11]。屈颈时脊髓前移位最大处的颈段横断面测量记录如下(图2):记脊髓后缘至椎管后壁的距离为X与椎管前后径为Y。用颈椎自然位和屈颈位X/Y的变化来表示颈脊髓的最大前移位程度,公式:屈颈位X/Y-自然位X/Y[25]。
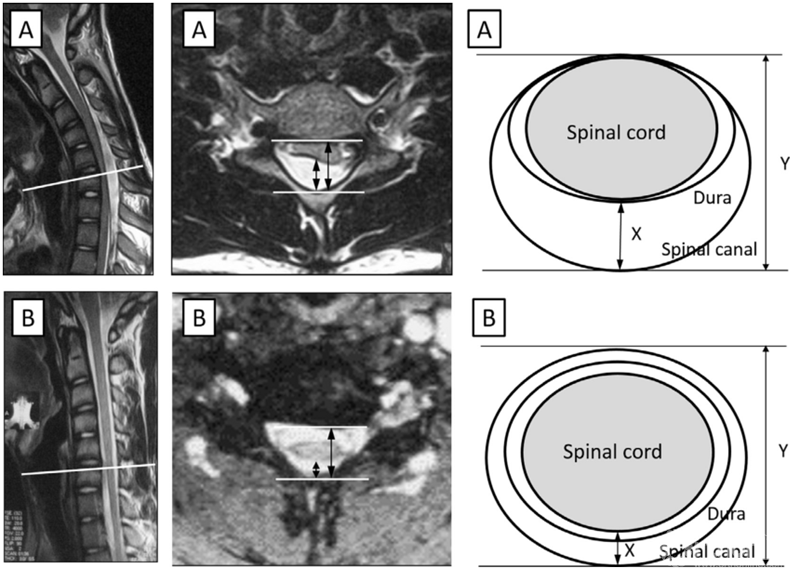
图2.利用影像学方法测量颈椎屈曲时颈脊髓最大前移程度。X:颈脊髓后缘至椎管后壁的距离;Y:椎管前后径
2.2.4临床检查
所有平山病患者均接受了进一步的临床检查,包括测定肌力、肌张力、下肢反射、Hoffmann征、Babinski征和Chaddock征,以评估上运动神经元的功能。
2.3统计学方法
所有数据均使用SPSS 12.0(IBM, USA)进行分析。采用Kolmogorov-Smirnov检验对正态分布数据进行检验。根据数据是否正态分布,采用独立t检验或Mann-Whitney检验,将平山病患者的H反射和M波测量结果与对照组进行比较。
用同样的方法对有上运动神经元受累临床症状和无上运动神经元受累临床症状的平山病患者的H反射和MRI的测量结果进行比较。此外,根据数据是否正态分布,使用配对t检验或Wilcoxon符号秩检验比较有症状侧与无症状侧的H反射和M波的测量值。
采用Pearson秩相关检验分析平山病患者脊髓最大前移位与VII及Hmax/Mmax比值的相关性。用同样的统计方法分析了病程与VII和Hmax/Mmax比值之间的相关性。采用Pearson秩相关检验评价病程与脊髓最大前移位之间的相关性。
P值<0.05被认为有统计学意义。
3 结果
表1列出了81名平山病患者和34名对照组受试者在比目鱼肌H反射测试和MRI测量的结果,表2列出了所有平山病患者的临床信息。
表1.平山病患者和对照组比目鱼肌H反射试验和动态MRI测量

平山病:平山病;S side:症状侧;Less-S side:症状较轻侧;Mmax:平均最大M波波幅;Hmax:平均最大h反射波幅;Hvib:50Hz振动时平均最大h反射波幅;VII:振动抑制指数;MRI:磁共振成像;X:脊髓后缘至椎管后壁的距离;Y:椎管前后径;f-s:前移位;P:症状侧和症状较轻侧的统计学差异。
*有核上受累临床表现与无核上受累临床表现的平山病患者差异有统计学意义。
#平山病患者与对照组之间有显著统计学差异。
数据来自Shao et al.(2015).
表2.平山病患者的临床信息

81例平山病患者中有6例平山病患者的VII(双侧3例,症状侧3例)明显高于对照组,占总患者数的7.4%,其中5例Hmax/Mmax比值异常(双侧3例,症状侧2例)(图1B和1C)(补充表S1)。6例平山病患者均有下肢反射亢进,其中4例锥体束征阳性。
平山病患者颈脊髓最大前移程度与VII和Hmax/Mmax比值均有显著相关性(症状侧:Hmax/Mmax比值, r=0.51, P<0.05;VII, r=0.81, P<0.05;症状较轻侧:Hmax/Mmax比值, r=0.60, P<0.05;VII, r=0.61, P<0.05)。
同样,我们还发现病程与症状侧VII(r=0.31, P<0.05)和双侧Hmax/Mmax比值(症状侧:r=0.36, P<0.05;症状较轻侧:r=0.29, P<0.05)正相关。本研究也证实了病程与颈脊髓最大前移位程度之间的相关性(r=0.37, P<0.05)。
4 讨论
本研究结果显示平山病患者比目鱼肌H反射VII和Hmax/Mmax比值可能升高。我们还证明了这些测量值与病程和颈脊髓最大前移位程度呈正相关。这些发现共同支持了平山病患者可能因反复颈椎屈曲运动导致颈脊髓损伤和病情进展加重的观点。
在最近的研究中,一些平山病患者比目鱼肌H反射波幅在跟腱受振动时明显减小,这一现象可能是由于振动可以选择性地刺激初级肌梭传入神经,导致一种可以引起突触前抑制的脊髓机制[4]。
既往研究证实VII升高与脊髓损伤有显著相关性[3,22],同时最近的病例报道进一步表明,随着疾病进展,部分平山病患者可能发展为颈椎前角以外的广泛颈脊髓损伤[18,23]。
因此,平山病者VII升高可能是由于由于反复颈椎屈曲运动导致的颈脊髓损伤降低了突触前抑制所致。本研究中报道的大多数平山病患者的锥体征阳性进一步支持了这一假设,特别是在单侧症状的病例中(如补充表S1中的2号与4号患者)。
与病程因素相比,颈脊髓前移位程度与皮质脊髓束的损伤有着更强的相关性。这更加支持了我们之前的研究结果,即平山病更可能表现为体位相关的功能障碍而非一种脊髓固有疾病[29]。
更重要的是,这些结果提示具有较严重颈椎屈曲结构异常的平山病患者可能更容易发生颈脊髓损伤,即使患者处于疾病的早期。这一假设也得到了之前所做研究的支持。之前的研究证明了轻度脊髓受压的应力只作用于灰质区域。然而,当脊髓受压加重时,灰质与白质区域所受压力均增加[12-13]。
此外,Sakai等学者报道了广泛的颈脊髓损伤的病例,这些损伤包括了UMN和LMN,因此认为早期平山病患者在颈部屈曲时也可能存在颈脊髓严重压迫[23]。因此,当临床医生看到平山病患者在颈椎屈曲过程中出现明显的颈脊髓前移位时,应该引起重视,并尽早采取更积极的治疗措施。
本研究发现颈脊髓最大前移位程度与病程呈显著正相关,提示平山病可能不是自限性疾病,这与我们之前的影像学研究结果一致[25]。虽然早期研究表明,平山病在发病2-4年后逐渐改善并呈自限性[6],但是Cerami等人和Boelmans等人都证明了一些平山病患者在经历了几个月或几年的稳定期后病情仍然可以快速进展[1-2]。
基于我们之前的研究结果,我们利用颈脊髓的跨突触损伤来探究压迫性损伤[32],我们认为除了轴突再生无法补偿LMN的持续损伤外,皮质脊髓束病变也可能参与平山病患者的第二次临床进展。然而,这一假设还有待后续进一步研究。
本研究的一个临床局限性是仅使用测量H反射的方法来评估UMN的功能。然而,这一神经生理学方法在评估运动神经元兴奋性时的高度可重复性,已在以前的研究中得到证实[17,20]。此外,测量VII和Hmax/Mmax比值都可在任何常规肌电图设备上进行,且操作相对简单,这减少了不同检测方法和操作人员对试验结果影响。
根据本研究结果,手术治疗可能是平山病更好的治疗选择,特别是对于颈部屈曲时颈脊髓前移较严重的患者。最近发表的一篇论文也证实了很多平山病患者术后预后良好[19]。当然,手术治疗也会受到诸多因素的影响[26]。因此,未来的研究方向可能会着眼于制定一个手术治疗的标准,即何种程度的颈椎屈曲异常才需要考虑手术治疗。
5 结论
本研究结果提示平山病患者可能随着疾病进展而发展为颈脊髓损伤,并由此导致UMN病变。即使在平山病的早期,颈椎屈曲结构异常相对严重的病例也非常有可能发生颈脊髓损伤。因此,临床医生在评估和处理平山病患者时应该谨慎,因为平山病患者可能会发生上肢远端严重肌肉萎缩和皮质脊髓束损伤。
致谢:
感谢上海市卫生系统财政支持的第二批重大疾病联合项目(2014ZYJ0008)和国家自然科学基金青年科学基金项目(81501909)对本研究的大力支持。
利益声明:
所有作者都没有潜在的利益冲突需要披露。作者对本文的内容和写作全权负责。
参考文献:
[1] Boelmans K, Kaufmann J, Schmelzer S, Vielhaber S, Kornhuber M, Münchau A, et al. Hirayama disease is a pure spinal motor neuron disorder–a combined DTI and transcranial magnetic stimulation study. J Neurol 2013;260:540–8.
[2] Cerami C, Valentino F, Piccoli F, La Bella V. A cervical myelopathy with a Hirayama disease-like phenotype. Neurol Sci 2008;29:451–4.
[3] Delwaide PJ. Human monosynaptic reflexes and presynaptic inhibition. In: Desmedt JE, editor. New developments in electromyography and clinical neurophysiology. Basel: S. Karger; 1973. p. 486–507.
[4] Dindar F, Verrier M. Studies on the receptor responsible for vibration induced inhibition of monosynaptic reflexes in man. J Neurol Neurosurg Psychiatry 1975;38:155–60.
[5] Fisher MA. AAEM Minimonograph #13: H reflexes and F waves: physiology and clinical indications. Muscle Nerve 1992;15:1223–33.
[6] Hirayama K. Non-progressive juvenile spinal muscular atrophy of the distal upper limb (Hirayama’s disease). In: De Jong JMBV, editor. Handbook of clinical neurology. Elsevier: Amsterdam; 1991. p. 107–20.
[7] Hirayama K. Juvenile muscular atrophy of distal upper extremity (Hirayama disease). Intern Med (Tokyo, Japan) 2000; 39: 283–90.
[8] Hirayama K. Juvenile muscular atrophy of unilateral upper extremity (Hirayama disease) –half-century progress and establishment since its discovery. Brain Nerve 2008;60:17–29. In Japanese.
[9] Hirayama K, Toyokura Y, Tsubaki T. Juvenile muscular atrophy of unilateral upper extremity: a new clinical entity. Psychiatr Neurol Jpn 1959;61:2190–7. In Japanese.
[10] Hirayama K, Tomonaga M, Kitano K, Yamada T, Kojima S, Arai K. Focal cervical poliopathy causing juvenile muscular atrophy of distal upper extremity: a pathological study. J Neurol Neurosurg Psychiatry 1987;50:285–90.
[11] Hou C, Han H, Yang X, Xu X, Gao H, Fan D, et al. How does the neck flexion affect the cervical MRI features of Hirayama disease? Neurol Sci 2012;33:1101–5.
[12] Ichihara K, Taguchi T, Sakuramoto I, Kawano S, Kawai S. Mechanism of the spinal cord injury and the cervical spondylotic myelopathy: new approach based on the mechanical features of the spinal cord white and gray matter. J Neurosurg 2003;99:278–85.
[13] Kato Y, Kataoka H, Ichihara K, Imajo Y, Kojima T, Kawano S, et al. Biomechanical study of cervical flexion myelopathy using a three-dimensional finite element method. J Neurosurg Spine 2008;8:436–41.
[14] Kimura J. Electrodiagnosis in diseases of nerve and muscle: principles and practice. New York, USA: Oxford University Press; 2001.
[15] Lapole T, Canon F, Pérot C. Acute postural modulation of the soleus H-reflex after Achilles tendon vibration. Neurosci Lett 2012;523:154–7.
[16] Lee JK, Emch GS, Johnson CS, Wrathall JR. Effect of spinal cord injury severity on alterations of the H-reflex. Exp Neurol 2005;196:430–40.
[17] Levin MF, Hui-Chan C. Are H and stretch reflexes in hemiparesis reproducible and correlated with spasticity? J Neurol 1993;240:63–71.
[18] Li Y, Remmel K. A case of monomelic amyotrophy of the upper limb: MRI findings and the implication on its pathogenesis. J Clin Neuromuscul Dis 2012;13:234–9.
[19] Lu F, Wang H, Jiang J, Chen W, Ma X, Ma X, et al. Efficacy of anterior cervical decompression and fusion procedures for monomelic amyotrophy treatment: a prospective randomized controlled trial: clinical article. J Neurosurg Spine 2013;19:412–9.
[20] Milanov I. A comparative study of methods for estimation of presynaptic inhibition. J Neurol 1992;239:287–92.
[21] Ongerboer de Visser BW, Bour U, Koelman JHTM, Speelman JD. Cumulative vibratory indices and the H/M ratio of the soleus H-reflex: a quantitative study in control and spastic subjects. Electroencephalogr Clin Neurophysiol 1989;73:162–6.
[22] Sadeghi M, Sawatzky B. Effects of vibration on spasticity in individuals with spinal cord injury: A scoping systematic review. Am J Phys Med Rehabil 2014;93:995–1007.
[23] Sakai K, Ono K, Okamoto Y, Murakami H, Yamada M. Cervical flexion myelopathy in a patient showing apparent long tract signs: a severe form of Hirayama disease. Joint Bone Spine 2011;78:316–8.
[24] Schieppati M. The Hoffmann reflex, a means of assessing spinal reflex excitability and its descending control in Man. Progr Neurobiol 1987;28:345–76.
[25] Shao M, Yin J, Lu F, Zheng C, Wang H, Jiang J. The quantitative assessment of imaging features for the study of Hirayama disease. Progression Biomed Res Int 2015;2015:803148.
[26] Song J, Wang H, Zheng C, Jiang J. Risk factors for surgical results of Hirayama disease: A retrospective analysis of a large cohort. World Neurosurg 2017;105:69–77.
[27] Taylor S, Ashby P, Verrier M. Neurophysiological changes following traumatic spinal lesions in man. J Neurol Neurosurg Psychiatry 1984;47:1102–8.
[28] Wang XN, Cui LY, Liu MS, Guan YZ, Li BH, DU H. A clinical neurophysiology study of Hirayama disease. Chin Med J (Engl) 2012;125:1115–20.
[29] Zheng C, Zhu Y, Yang S, Lu F, Jin X, Weber R, et al. A study of dynamic F-waves in juvenile spinal muscular atrophy of the distal upper extremity (Hirayama disease). J Neurol Sci 2016;367:298–304.
[30] Zheng C, Zhu D, Lu F, Zhu Y, Ma X, Xia X, et al. Compound muscle action potential decrement to repetitive nerve stimulation between Hirayama disease and amyotrophic lateral sclerosis. J Clin Neurophysiol 2017a;34:119–25.
[31] Zheng C, Zhu Y, Zhu D, Lu F, Xia X, Jiang J, Ma X. Motor unit number estimation in the quantitative assessment of severity and progression of motor unit loss in Hirayama disease. Clin Neurophysiol 2017b;128:1008–14.
[32] Zheng C, Zhu Y, Lu F, Ma X, Tian D, Jiang J. Trans-synaptic degeneration of motoneurons distal to chronic cervical spinal cord compression in cervical spondylotic myelopathy. Int J Neurosci 2017c;127:988–95. https://doi.org/ 10.1080/00207454.2017.1287701.
[33] Zhou B, Chen L, Fan D, Zhou D. Clinical features of Hirayama disease in mainland China. Amyotroph Lateral Scler 2010;11:133–9.
相关阅读:
华山骨科“平山病”系列研究之一—— 颠覆传统观念的“严重”神经系统疾病


 京公网安备11010502051256号
京公网安备11010502051256号