无细胞脂肪活性蛋白治疗骨关节炎研究
2022-06-16 文章来源:上海交通大学医学院附属第九人民医院 作者:张文杰 我要说
PART 1 介绍
骨关节炎(Osteoarthritis,OA)是一种常见的退行性疾病,以关节软骨逐渐退化、滑膜炎症、软骨下骨重塑为特征。骨性关节炎的生理症状主要包括疼痛、关节僵硬、活动减少等,极大影响患者的生活质量。目前对OA的治疗方案包括非手术治疗(如减肥、运动)和非甾体抗炎药、扑热息痛等药理干预,只能暂时缓解临床症状,并不能修复组织病变或抑制OA的进展。此外,全关节置换术是治疗终末期关节疾病的有效方法,但人工关节的寿命有限,功能结果可能较差。因此,研究团队将重点转移到早期OA的治疗上。
越来越多的证据表明,关节软骨组织的凋亡和先天炎症通路(尤其是巨噬细胞)的激活在OA的发生发展中发挥着关键作用。这一现象与巨噬细胞亚型密切相关,包括促炎M1或抗炎M2状态。M1巨噬细胞会分泌促炎细胞因子和介质,可以趋化其他免疫细胞聚集,从而引起炎症反应。M2巨噬细胞分泌IL-10等抗炎因子、高表达甘露糖受体(CD206),促进组织修复。具体而言,在 OA初期,炎症为保护作用,可以清除部分细胞碎片,介导骨关节中微环境向正常方向进展。但在OA后期,由于巨噬细胞中的 M1亚群不能向 M2亚群转换,M2亚群介导的胶原及蛋白聚糖等细胞基质成分的合成不能进行,导致组织损伤的持续存在,发展为慢性低度的炎症。
此外,活性氧(ROS)的产生,也是导致慢性炎症的重要原因。由于炎症介质和氧化应激的存在和相互作用,关节腔长期处于炎症状态,进一步加速了软骨降解和关节功能障碍的进展。
我们可以由此得知,治疗OA的关键在于开发一种具有抗炎特性的多功能药物,能够改变促炎微环境,促进软骨再生。近年来的临床试验和基础研究已经揭示了间充质干细胞(mesenchymal stem cells,MSCs)、骨骼干细胞和脂肪干细胞(adipose-derived stem cells,ADSCs)可用于OA的细胞治疗,几种干细胞主要通过旁分泌的方式释放丰富的生长因子和抗炎细胞因子来发挥其再生和免疫调节作用,然而,由于细胞治疗的免疫排斥和致瘤性限制了其应用。
基于此,来自上海的科学家团队把目光转移到无细胞脂肪活性蛋白(Cell-Free Fat Extract,CEFFE)上。CEFFE较容易获得的脂肪衍生物,是从纳米脂肪(Nanofat)中去除细胞成分和脂质残余而纯化出的部分。CEFFE富含多种生长因子和抗炎成分,包括胰岛素样因子-1(IGF-1)、转化生长因子(TGF)-β、血管内皮生长因子(VEGF)、碱性成纤维细胞生长因子,类似于ADSCs的旁分泌因子具有抗凋亡、抗氧化和促进增殖的功能,是新一代无细胞介导的组织再生修复技术。
PART 2 实验
研究团队推测CEFFE对早期OA有治疗作用,并通过实验评估CEFFE对软骨再生和巨噬细胞极化的影响。

所有大鼠模型饲养在屏障环境中,随机分为5组:对照组、模型组、CEFFE低剂量组、CEFFE中剂量组、CEFFE高剂量组。对照组大鼠从第7天开始至实验结束为止不接受任何治疗,其余各组大鼠单次注射50 uL碘乙酸钠,建立OA模型。在第0、14、28和42天,为大鼠关节内多次注射模型组(60uL生理盐水),低剂量组(15μL CEFFE+45μL生理盐水,0.0357毫克/膝盖),中剂量组(30μL CEFFE+30μL生理盐水,0.075毫克/膝盖),高剂量组(60μL CEFFE,0.15毫克/膝盖),总共四次。
PART 3 结果
CEFFE显著降低OA症状
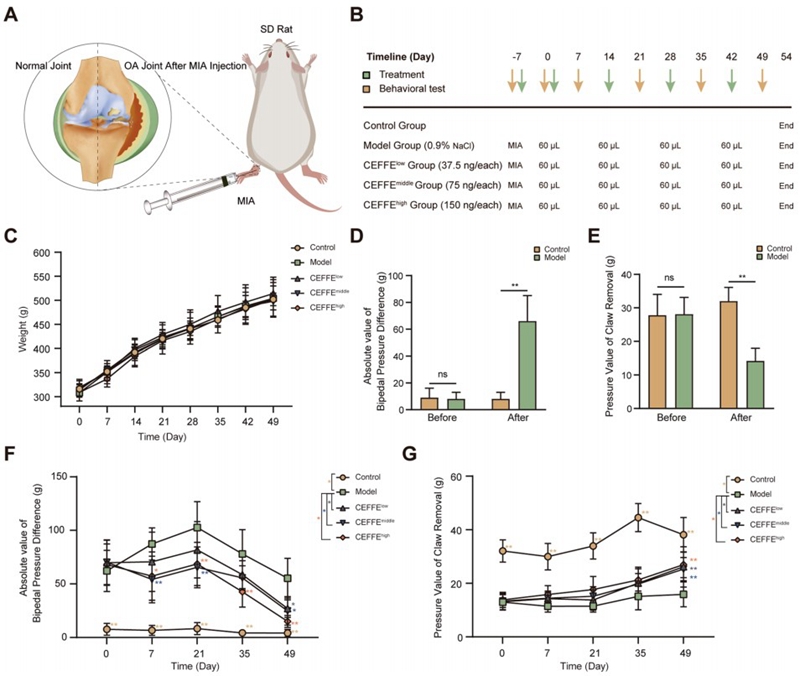
研究团队观察CEFFE对关节软骨损伤的治疗效果,在实验持续时间内,未观察到任何明显的临床体征和组间体重差异。建模前,两足压力和爪回缩压力在对照组和模型组之间无显著差异。然而建模7天后产生了明显的不同,表明MIA成功诱导了大鼠OA。与此同时,从第一次给药到实验结束,中剂量组和高剂量组组的绝对值都低于模型组;在实验结束时,三个CEFFE处理组大鼠的爪回缩压力均明显高于模型组。说明CEFFE能减轻OA症状的严重程度。
CEFFE促进软骨修复的机制研究

研究团队通过特殊染色和免疫组化研究CEFFE介导的治疗作用机制。HE和S&F染色显示,与模型组相比,中剂量组和高剂量组组关节切面大体形态更接近对照组。模型组的关节软骨浅表区消失,关节软骨内部结构发生改变;而CEFFE治疗组随着CEFFE浓度升高,软骨结构逐渐向正常对照组转变。HE染色(软骨纤维化、软骨退变)和S&F染色(OARSI)也呈现出随CEFFE浓度增加而下降的趋势。甲苯胺蓝染色及II型胶原免疫组化检测显示模型组软骨基质中GAG和II型胶原均减少;然而,关节内注射CEFFE后,这种效应被逆转。根据CD68染色可知,CEFFE处理组和模型组的总巨噬细胞浸润(CD68阳性细胞)没有差异。由此研究团队发现,与模型组相比,CEFFE上调了滑膜M2巨噬细胞(CD206阳性细胞)的比例。此外,CD31染色结果显示滑膜组织毛细血管密度呈上升趋势。
CEFFE抑制Raw 264.7细胞由M0向M1巨噬细胞转化

为了验证CEFFE具有良好的炎症缓解作用,研究团队用LPS+IFN-γ刺激Raw 264.7细胞,同时用不同浓度的CEFFE进行处理。流式细胞术分析显示,LPS+IFN-γ显著刺激M0巨噬细胞向M1(CDd86阳性,促炎细胞)极化,从1.62增加到59.74%。同时研究团队观察到,M1巨噬细胞的比例以CEFFE浓度依赖性的方式逐渐降低。
为了进一步探索CEFFE在解决炎症方面的潜在作用,研究团队进行了促炎和抗炎因子的qRT-PCR检测。qRT-PCR分析显示,LPS+IFN-y组中IL-1β、IL-6、iNOS和TNF-a促炎因子的mRNA表达水平显著升高。相反,在经过不同浓度的CEFFE处理后,mRNA表达呈现出显著的剂量依赖性下降。同时,与LPS+ IFN-y组相比,LPS+ IFN-y组中ARG、IL-10和TGF-B抗炎因子mRNA表达量略有上升。
CEFFE促进软骨细胞的增殖、再生、减少基质降解和减轻炎症

为了研究CEFFE对软骨细胞的影响,研究团队分离并使用大鼠软骨细胞,分别用不同浓度的CEFFE进行。结果显示,CEFFE能促进软骨细胞的增殖,可以证实CEFFE对炎症条件下软骨细胞的生长有保护作用。
研究团队为了进一步探索相关机制,检测了作为促炎症标志物的白细胞介素-6(IL-6),作为最显著的基质降解酶标志物之一的血小板结合蛋白基序的解聚蛋白样金属蛋白酶(ADAMTs-5),以及作为软骨细胞再生标志物的SOX-9的表达。研究团队发现,当初级软骨细胞使用CEFFE处理时,SOX-9的表达增加,而ADAMTs-5的表达降低。此外,原代软骨细胞与炎症因子共培养时,SOX-9的表达降低,而ADAMTs-5和IL-6的表达增加;用CEFFE处理炎症软骨细胞后,SOX-9的表达增加,而ADAMTs-5和IL-6的表达降低。
CEFFE抑制炎症诱导的RAW264.7巨噬细胞和小鼠软骨细胞氧化应激
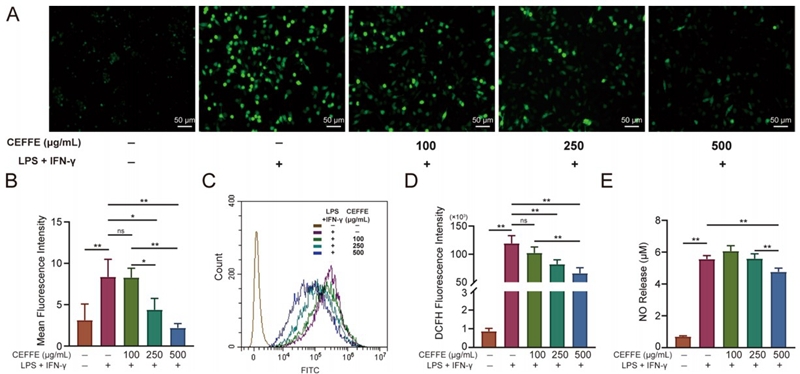
为探讨CEFFE对RAW264.7巨噬细胞和软骨细胞的作用机制,研究团队检测了细胞内ROS水平,研究发现,CEFFE提升了软骨细胞中关键抗氧化酶的表达水平,以剂量依赖的方式降低了软骨细胞氧化程度。
研究团队还观察到,CEFFE降低了炎症激活关键蛋白COX-2和iNOS的表达。
PART 4 讨论
在本项研究中,证明了CEFFE可以对OA模型起到软骨再生和炎症缓解作用 ,并证实了CEFFE对RAW 264.7巨噬细胞和软骨细胞的潜在治疗机制。
炎症改变,尤其是骨关节中巨噬细胞极化与OA的发病和进展息息相关。在目前的研究中,证实了CEFFE在体内和体外调节巨噬细胞的有效性。通过体内实验,研究团队发现CEFFE增加了骨关节中抗炎M2巨噬细胞的比例,而通过体外实验,可发现CEFFE通过抑制巨噬细胞M0到M1极化来介导炎症反应。与此同时,CEFFE降低了IL-1β、IL-6、iNOS和TNF-α促炎因子的表达,但增加了ARG和IL-10抗炎因子的表达。
ROS水平的升高导致氧化应激升高,直接损伤DNA、脂质和蛋白质,在OA的发生发展中也起着重要作用。消除过量的ROS可以促进软骨重建和OA恢复。在本项研究中,研究团队在体外巨噬细胞和软骨细胞模型中证实了CEFFE的抗氧化能力。在RAW264.7细胞中,CEFFE主要通过增加抗氧化酶的表达来减少ROS的产生,而在软骨细胞中,CEFFE通过减少氧化应激相关酶的表达来发挥其作用。
OA的另一个基本特征是炎症状态下的软骨破坏。II型胶原蛋白是软骨的主要蛋白成分,软骨长期降解导致软骨细胞活化,其特征是产生炎性细胞因子,如IL-1β、TNF-α,以及基质降解酶,包括金属蛋白酶(MMP)和ADAMTs-5。团队之前的研究表明,CEFFE含有多种促进成纤维细胞和表皮细胞增殖和再生的生长因子。而本项研究证实了CEFFE在体内外可直接促进软骨再生,降低基质金属蛋白酶和炎症介质水平。在这些细胞因子中,TGF-β可能是刺激软骨再生的关键因子,因为它促进了SOX-9和II型胶原的表达。
综上所述,结合CEFFE在调节巨噬细胞极化、消除过量氧化应激和软骨保护作用的优秀表现,CEFFE或可成为一种有希望的策略——通过促进软骨再生和降低关节炎症来抑制OA的发生和进展。
原文链接:
<Cell-free fat extract attenuates osteoarthritis via chondrocytes regeneration and macrophages immunomodulation> Jia et al. Stem Cell Research & Therapy (2022) 13:133
https://doi.org/10.1186/s13287-022-02813-3
作者简介

张文杰
上海交通大学医学院附属第九人民医院研究员、教授、博士生导师
上海交通大学医学院附属第九人民医院干细胞制剂质量授权人
上海卫健委干细胞与再生医学创新集群项目联合主席
1992年毕业于上海第二医科大学医疗系,1995年赴日本浜松医科大学留学,2000年毕业取得博士学位,后赴美国华盛顿大学医学部做博士后,一直从事干细胞研究,在干细胞定向诱导分化和分离纯化方面积累了丰富的经验。2004年回国,作为特殊人才引进入上海交通大学医学院附属第九人民医院,在上海市组织工程研究重点实验室继续从事干细胞领域基础与应用研究,特别在临床转化应用方面取得了突破性进展,建立了针对缺血性疾病、软组织再生修复、难愈性创面等多种疾病的生物治疗新技术。


 京公网安备11010502051256号
京公网安备11010502051256号