退行性颈脊髓病发病机制的相关研究进展
2022-11-29 点击量:1346 我要说
作者:陈锐 周非非
医院:北京大学第三医院骨科
退行性颈脊髓病(degenerative cervical myelopathy,DCM)是成年人脊髓功能障碍主要病因,尽管大部分患者能够在术后获得良好预后,部分患者的神经功能和生活质量改善情况仍不满意,单纯手术减压无法获得良好转归。
DCM减压术后3-12个月时,部分症状会复发,暗示了脊髓中发生了潜在的神经再生、修复过程,提示我们可以从非手术治疗方法中寻找新的治疗思路。成功的药物需要有效可行的机制研究靶点,笔者基于已知的DCM发病机制、轴突退变、沃勒变性、SARM1蛋白等角度进行综述。
椎间盘结构破坏(如环状撕裂、椎间盘膨出或突出、椎间盘高度降低)、骨赘增生、韧带肥厚和钙化等一系列退行性改变可导致DCM中缺血、血脊髓屏障破坏、神经炎症、细胞凋亡等病理生理学进程。
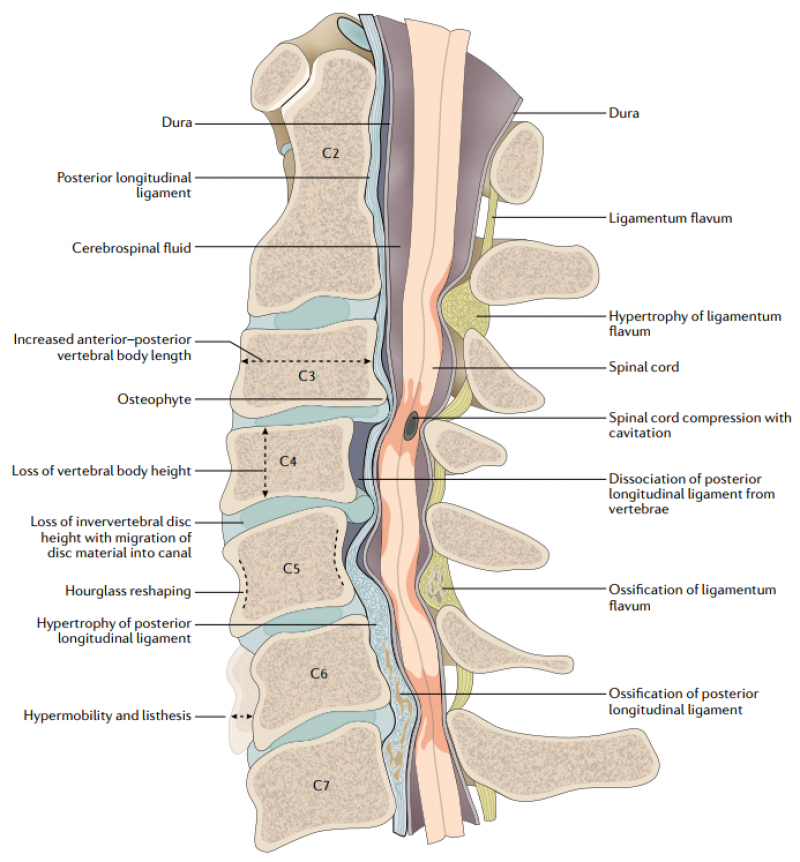
图1:退行性颈脊髓病的病理生理学示意图
长期以来,脊髓灌注受损一直被认为是DCM的一个核心病理生理学过程。慢性压迫减少了区域性脊髓血流,局部血管变形导致进一步缺血。 然而,有研究尝试利用药物(如利鲁唑)逆转缺血再灌注所造成的损伤,但疗效并不显著,考虑缺血仅仅只是 DCM 病理生理机制的冰山一角而已。
血脊髓屏障(blood-spinal cord barrier,BSCB)的破坏被认为在DCM中也有作用,慢性颈脊髓压迫被认为会导致内皮细胞的损伤和功能障碍,而内皮细胞对BSCB的完整性至关重要;缺血导致的脊髓实质的缺氧细胞死亡会加剧BSCB的损害。
DCM的血管通透性增加,可能因BSCB受损而加剧,促进了脊髓实质的水肿,并促使炎症细胞从外周循环进入,导致了小胶质细胞的激活和压迫部位巨噬细胞的招募,从而脊髓内产生了大量的促炎症细胞因子。
慢性缺血和神经炎症汇聚在凋亡途径的激活上,导致神经元和少突胶质细胞的渐进性死亡和临床神经功能障碍。在DCM的小鼠模型中,阻断凋亡信号通路可以减少细胞凋亡,减轻炎症,促进轴突修复,改善神经行为功能,但转化至人体使用仍有一段很长的距离。

图2:退行性颈脊髓病的病理生理学进程
DCM发病机制研究的局限性限制了退行性脊髓型颈椎病疗效,因此需要找到新的研究突破口。有研究显示DCM的组织病理学特征包括了脱髓鞘、胶质增生、微囊空洞、中央灰质和内侧白质变性、上升和下降束的沃勒变性(Wallerian degeneration,WD),以及背角和腹角的萎缩。
尸检研究表明,在DCM的早期阶段,容纳外侧皮质脊髓束的外侧漏斗内有轴索丢失。轴索损伤和沃勒变性可能在DCM神经功能恶化中起到重要作用,轴突退变很可能是DCM发病机制研究的新突破口。
图3:沃勒变性
在动物和人类的大量研究表明,脊髓损伤后,轴突剩余部分在数小时内保持形态学稳定,损伤轴突的远端残端会发生一个退变性的过程,即沃勒变性(Wallerian degeneration,WD),而同时近端残端则出现收缩。这种形态学上的进展性碎裂与急性轴突变性所见到的碎片化类似。它沿着轴突方向进行,最终导致轴突远端完全去除。
尽管巨噬细胞和胶质细胞协助清除最终的轴突碎片,但是WD背后的分子生物学机制是轴突所固有的,WD的关键分子是烟酰胺单核苷酸苷转移酶(nicotinamide mononucleotide adenylyltransferase,NMNAT),该分子在生理条件下具有神经保护作用,但损伤后不再沿着轴突运输,从而导致远端轴突死亡。

图4:NAD+骤降导致SARM1激活、NAD+进一步消耗
SARM1(sterile alpha and Toll/interleukin-1 receptor motif-containing protein 1)是近些年发现的沃勒变性中一个核心调控蛋白,即SARM1在轴突退变进程中起着核心作用。SARM1属于TLR适配体家族,编码一种含有SAM(sterile alpha motif)和ARM(armadillo motif)结构域的蛋白,因此命名为SARM,又因为其C末端有Toll/IL-1受体(TIR)结构域而更名为SARM1。许多研究结果证明,SARM1蛋白与NAD+代谢直接相关。例如有研究显示SARM1缺失完全阻断了NMNAT2缺陷小鼠的轴突病理进程。
此外,SARM1的激活诱导轴突NAD+水平的急剧消耗。SARM1属于TIR(Toll/IL-1受体)结构域适配器家族。来自果蝇、斑马鱼、小鼠或人类的SARM1 TIR结构域重组蛋白可以在生化分析中降解NAD+分子。这种降解NAD+的能力被称为NADase活性,与ADPR(adenosine diphosphate ribose)或cADPR(cyclic ADPR)共同产生烟酰胺。
因此,研究表明轴突cADPR水平在受损的轴突中增加,而这将被SARM1的缺失所消除。此外,SARM1的缺失阻止了轴突NAD+水平的消耗。重要的是,哺乳动物SARM1蛋白的NADase活性依赖于TIR结构域的关键谷氨酸残基Glu642。E642A突变抑制了SARM1的NADase活性及其触发创伤性轴突退变的能力。这一发现揭示了SARM1作为NAD+降解酶控制着病理性轴突退变的进程。

图5:SARM1分子结构
SARM1 蛋白持续存在于神经元和轴突中,但其介导轴突退变过程的作用仅对轴突损伤有反应。 这一发现强调,必须存在一种特定的机制,以保持在健康情况下轴突中的SARM1活性被有效抑制,同时确保其在神经退行性损伤时又被有效激活。
研究发现,SARM1通过SAM(sterile alpha motif)结构域之间的相互作用被组织成一个八聚体。此外,TIR结构域可能通过与ARM(Armadillo motif)结构域的相互作用而被限制为非活性结构域,TIR结构域与ARM结构域形成疏水界面,导致NADase活性的催化位点发生物理阻断。
随着这种SARM1自我抑制机制的确定,一个重要的问题出现了,即SARM1如何能够感知轴突损伤?这个问题可以由上述的SARM1的结构分析来解答。那么,SARM1的调控机制又是怎么样的呢?换句话说,SARM1是如何从非激活状态切换到激活状态的?
令人惊讶的是,有研究证明,ARM结构域包含一个以往人们未知的NAD+结合口袋。这个口袋中几个带正电荷的残基的突变会严重破坏NAD+的结合。更重要的是,这种突变产生了SARM1的过度活跃的NADase活性,足以启动轴突退变,而不需要神经变性损伤。这一发现表明,NAD+分子是SARM1蛋白的负变构调节因子。
NAD+作为负变构调节因子,其浓度是NAD+参与调控的关键因素。生化分析表明,当NAD+浓度低于150μM时,SARM1的NADase活性会增强。相反,当NAD+浓度超过500μM时,NADase活性受到强烈抑制。正如预期的那样,没有ARM结构域的SARM1突变蛋白对高水平NAD+的抑制作用不敏感。
耐人寻味的是,这些结果与哺乳动物细胞内NAD+水平在健康条件下维持在500~1000μM的事实相关。因此,可以想象,在完整的轴突中,NAD+的高浓度足以通过ARM结构域的NAD+强制抑制使SARM1蛋白处于非活性状态。
另一方面,这种NAD+对SARM1的强制抑制会被轴突NAD+水平的下降所打断,这是由于神经退行性损伤时NMNAT2的缺失或局部膜的破裂,然后活性的SARM1降解更多的NAD+分子,在受损的轴突中形成NAD+消耗的前正反馈。SARM1作为一种NAD+降解酶,同时又受NAD+的变构调节,这种独特的调控机制实现了对病理性轴突退变的精确控制,但具体调控机制尚未阐明,需要更深入的实验与探究。
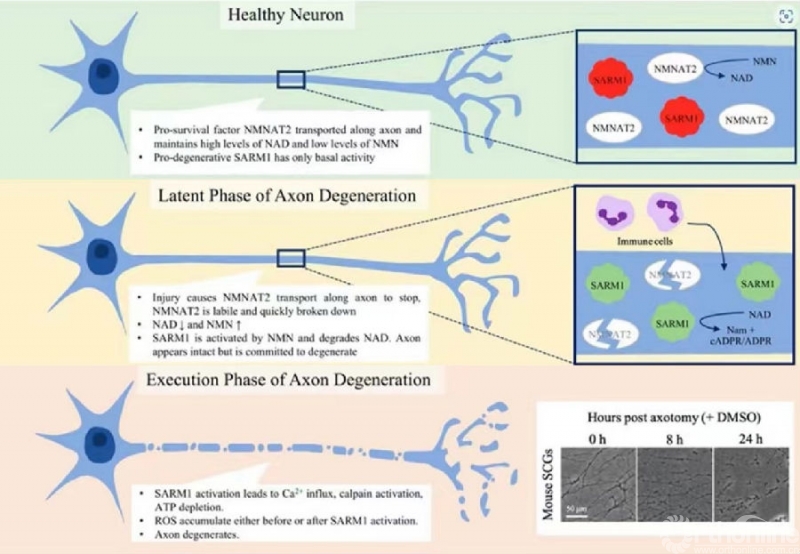
图6:轴突退变的细胞分子学进程
同时,在DCM的治疗方法的研究中,我们试想,能否通过拓展药物治疗靶点完善DCM的综合治疗方案? 例如通过调控体内NAD+的浓度从而选择性抑制SARM1表达进而抑制轴突退变,最终达到延缓DCM恶化的效果。再例如,能否利用SARM1抑制剂对颈脊髓轴突退变进行人为干预,使得药物治疗匹配已有的减压手术,最大程度提高DCM的疗效,而这些假设亟待进一步研究与验证。
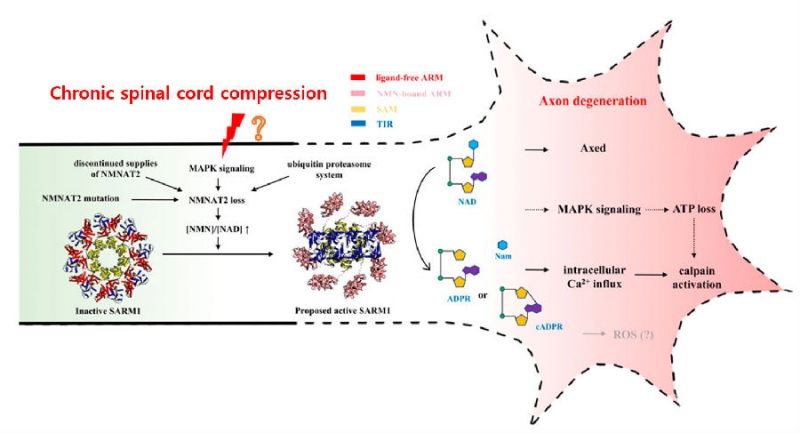
图7:慢性颈脊髓压迫与轴突退变可能潜在的关系
图片来源:
图1、2来自于:Badhiwala, Jetan H et al. “Degenerative cervical myelopathy - update 、and future directions.” Nature reviews. Neurology vol. 16,2 (2020): 108-124.
图3来自于:Benjamini, Dan et al. “Direct and specific assessment of axonal injury and spinal cord microenvironments using diffusion correlation imaging.” NeuroImage vol. 221 (2020): 117195.
图4来自于:Figley MD, DiAntonio A. The SARM1 axon degeneration pathway: control of the NAD+ metabolome regulates axon survival in health and disease. Curr Opin Neurobiol. 2020, 63: 59-66.
图5来自于:Liu HW, Smith CB, Schmidt MS, Cambronne XA, Cohen MS, Migaud ME, Brenner C, Goodman RH. Pharmacological bypass of NAD+ salvage pathway protects neurons from chemotherapy-induced degeneration. Proc Natl Acad Sci U S A. 2018, 115(42): 10654-10659.
图6来自于:Hopkins, Eleanor L et al. “A Novel NAD Signaling Mechanism in Axon Degeneration and its Relationship to Innate Immunity.” Frontiers in molecular biosciences vol. 8 703532. 8 Jul. 2021, doi:10.3389/fmolb.2021.703532
作者简介

陈锐
中山大学中山医学院本科毕业,2021年考入北京大学第三临床医学院,现北京大学第三医院外科学专业型硕士就读,研究方向为脊柱外科学、骨科学,荣获2021-2022年度北京大学医学部三好学生、北京大学优秀学生二等奖学金。在脊柱外科学、基础医学领域多次于国内外会议、SCI及核心期刊中发表文章。
周非非


 京公网安备11010502051256号
京公网安备11010502051256号