2023盘点|再生医学在关节外科中的应用与发展
2024-02-05 文章来源:上海长征医院关节外科 作者:周义钦 韩亚光 钱齐荣 我要说
2023盘点|再生医学在关节外科中的应用与发展
作者:周义钦 韩亚光 钱齐荣
来源:上海长征医院关节外科
关节疾病是骨科领域的常见疾病,可导致关节疼痛及功能受限,从而对人民的生活质量造成较大影响,关节疾病的热点与难点主要聚焦于关节软骨的再生修复研究。尽管过去几十年来再生医学领域取得了相当大的成就,但由于关节软骨在组成、结构和功能方面的时空复杂性,关节软骨损伤再生仍然是肌肉骨骼系统疾病中的一个具有挑战性的问题。本文将主要结合2023年度发表的部分高质量文章为大家从种子细胞、细胞支架以及影响因素三个方面展开分享再生医学在关节外科领域的最新应用与发展。
1、种子细胞
组织工程是再生医学的基础,而种子细胞是组织工程三大要素之一。目前,既往基础研究中用于软骨再生修复研究的种子细胞主要包括软骨细胞、干细胞、基因修饰细胞等。干细胞中则包括多种来源(骨髓、脂肪、脐带等)的间充质干细胞、胚胎干细胞以及诱导多能干细胞等。而在临床应用方面,已有一些关于软骨细胞和间充质干细胞治疗软骨病损的临床试验在开展。本部分内容则是主要为大家分享目前最新的研究成果。
上海长征医院关节外科钱齐荣教授团队近年来围绕髌下脂肪垫源性间充质干细胞(IPFP-ADSC)治疗关节软骨病损等相关领域开展了一系列基础及临床研究工作。研究团队首先在《Stem Cells International》基础研究中明确了IPFP-ADSC及其分泌的外泌体均具有较好的促软骨修复作用,而其团队又通过一项前瞻性随机对照研究结果表明对于关节软骨损伤患者在膝关节镜术中使用富含百万级的IPFP-ADSC的髌下脂肪垫细胞浓聚物治疗是安全有效的,且有助于减轻膝关节软骨损伤患者的疼痛和并改善关节功能[1]。并且其研究中还指出目前干细胞治疗的关键是依靠干细胞的旁分泌作用通过分泌细胞因子及外泌体等发挥调控修复作用,而不是自身参与组织的修复。
来自华中科技大学同济医学院附属同济医院康复科陈红教授的研究团队在《Signal Transduction and Targeted Therapy》上公开发表了一项重要研究成果:其发现来源于人胚胎干细胞(human embryonic stem cells, hESCs)的免疫与基质调节细胞(Immunity-and-matrix-regulatory cells, IMRCs)在受到半月板损伤患者的关节滑液刺激时会表现出强大的免疫调节和促再生能力,由此他们进行了一项I期临床研究 (NCT03839238),发现患者关节内注射 IMRCs不仅安全且对于半月板损伤具有良好的修复效果,这是首个IMRCs治疗半月板损伤的人体I期临床研究[2]。该研究从基础到临床十分完整的论证了IMRCs是半月板组织再生修复的优异种子细胞。
大阪大学医学院肌肉骨骼再生医学系Kosuke Ebina教授团队在《Osteoarthritis and Cartilage》上发表的研究成果发现用碱性成纤维细胞生长因子(bFGF)培养的滑膜间充质干细胞(SMSC)可促进CXCL6的表达,能增强细胞迁移、增殖和软骨分化,从而更好地实现半月板再生和软骨保存[3]。该文章一方面再一次论证了SMSC作为关节软骨种子细胞的优势,另一方面则提出bFGF可能是影响SMSC发挥作用的关键因子。
北京放射医学研究所朱恒教授团队在《Stem Cell Research & Therapy》上发表的成果提到其团队从骨关节炎关节软骨中分离出人类关节软骨干细胞(ACSC),并探讨了ACSCs对骨关节炎破骨细胞的调节及其体内和体外的潜在机制,研究表明ACSC显示出典型的干细胞样特征,包括集落形成和定向软骨分化能力。并通过动物实验证实膝关节内注射ACSCs对骨关节炎大鼠的异常软骨下骨重塑产生了显着改善。生物信息和功能学分析表明,ACSCs能抑制骨关节炎破骨细胞的形成,而炎症性关节微环境增强了这种抑制作用。进一步的研究表明,ACSC来源的肿瘤坏死因子α诱导蛋白3(TNFAIP3)对抑制骨关节炎破骨细胞和改善异常软骨下骨重塑有显着贡献[4]。尽管该文章并非第一篇报道ACSC的研究,但该研究报道了一种简单且可重复的人类 ACSC 分离策略,并通过以关节微环境响应方式释放 TNFAIP3 和抑制破骨细胞,揭示了它们对 OA 大鼠软骨下骨重塑的影响。
2、细胞支架
细胞支架也是组织工程的三要素之一,近年来关节软骨再生修复相关的细胞支架研究发展迅速,特别是在生物材料方面,在2023年度也有诸多重要成果发布。南京大学医学院附属鼓楼医院蒋青教授团队在国际顶刊《Nature》上报道了一种使用链缠结显著硬化蛋白质基水凝胶而不影响其韧性的方法。通过在折叠的弹性蛋白构成的水凝胶网络中引入链缠结,可以设计出高硬度、高韧性的蛋白质水凝胶,且无缝地结合了高刚度、高韧性、快速恢复和超高抗压强度等相互不相容的力学性能,有效地将软性蛋白生物材料转化为力学性能接近软骨的高韧性材料[5]。
香港中文大学医学院骨科再生医学实验室李刚教授团队则在《Bioactive Materials》上发表的成果中提出了一种具有内源性干细胞募集能力的支架策略,该策略以o-alg-THAM/gel水凝胶系统作为支架,以hBMSCs衍生的生物活性微球作为活性成分。其中,工程化的生物活性微球(Microspheres of extracellular matrix(ECM)and solidified secretome, MESS)是基于 hBMSC的分泌而设计的。脉冲电磁场(Pulsed electromagnetic fields, PEMF)能增强MESS的质量和生物学功能。PEMF增强的 MESS(PE-MESS)可以促进干细胞在体外和体内的募集、迁移和聚集。团队研究证实负载PE-MESS的o-alg-THAM/gel水凝胶系统通过内源性干细胞募集增强软骨修复[6]。该策略的优势就在于作为生物支架的同时兼具可以富集内源性干细胞的能力。
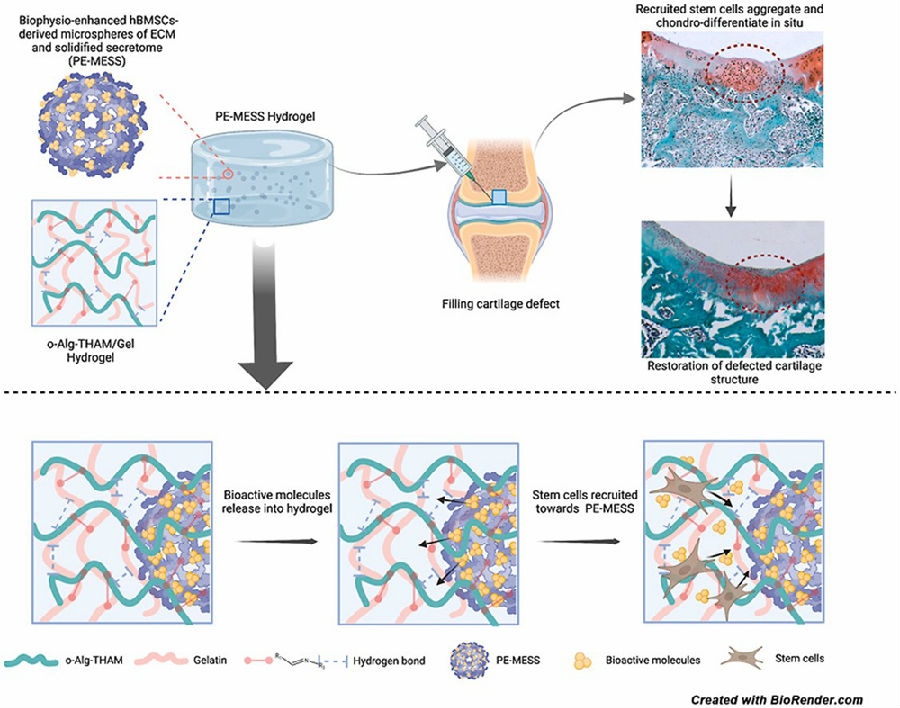
图1 负载PE-MESS的o-alg-THAM/gel水凝胶系统通过内源性干细胞募集增强软骨修复
相比起传统的细胞支架可能面临的临床转化难题,可注射使用的生物材料可能有更好的临床应用前景,康涅狄格大学生物医学工程系Thanh D. Nguyen教授团队在《Nature Communications》上发表论文并提出了一种可注射、可生物降解的压电水凝胶(piezoelectric NF-sPLLA hydrogel),由嵌入胶原基质内的短静电纺丝聚左旋乳酸纳米纤维制成,可以将其注射到关节中,并在超声波激活下自行产生局部电信号,以驱动软骨愈合。体外实验显示,超声压电水凝胶可以增强细胞迁移并诱导干细胞分泌内源性TGF-β1,从而促进软骨形成。同时体内实验也显示出软骨下骨形成增加、透明软骨结构改善和良好的机械性能接近健康的原生软骨[7]。
苏州市立医院郝跃峰教授和上海交通大学附属瑞金医院崔文国教授团队在《Advanced Healthcare Materials》上公开发表了他们两个团队的联合研究成果:其开发出一种新型多孔微球(PLGA-CS@KGN)作为干细胞扩增载体。体内外实验表明PLGA-CS微球具有较高的细胞承载能力并能为MSCs提供有效的保护,并可以注射进入关节腔内以使其在骨关节炎微环境中的控释。同时,微球内负载的KGN与PLGA-CS有效配合,诱导MSCs分化为软骨细胞[8]。
近年来生物3D打印技术的发展也十分迅速,上海长征医院关节外科钱齐荣教授团队在《Chemical Engineering Journal》上发表的成果提到其成功的研发了一种用于关节软骨生物3D打印的组织源性生物墨水,通过将髌下脂肪垫干细胞(IPFP-ADSC)与软骨脱细胞基质(dCECM)混合在温度响应水凝胶中形成了组织源性3D打印生物墨水并成功打印出了关节软骨制品,其可以有效促进了IPFP-ADSC中软骨分化相关生长因子的表达,并促进软骨分化,从而增强软骨缺损的修复[9]。中国人民解放军总医院骨科研究所郭全义教授团队发表在《Biomaterials Research》的研究成果显示其首次在 LDM(low-temperature deposition manufacturing)生物3D打印中单独使用ECM作为生物墨水,成功研制了包含GDF-5的分层多孔 ECM支架。体内外实验结果显示ECM/GDF-5支架不仅将大量干细胞募集到缺损区域,而且为MSCs提供了理想的再生微环境,并且动物实验证明ECM/GDF-5支架可促进体内软骨损伤原位修复,表明该支架在软骨损伤原位再生组织工程方面具有巨大潜力[10]。这些研究一方面表明生物3D打印技术在软骨再生修复领域是一个很有前景的技术,另一方面也说明近年来我国学者在生物3D打印技术以及相关的生物墨水研发取得了不错的成绩。

图2 低温3D打印制备含GDF-5的分层多孔ECM支架促进关节软骨再生
对于关节软骨的支架结构设计方面,关节软骨的仿生结构备受推崇。受天然骨软骨的(osteochondral, OC)双层特征的启发,苏州大学附属第一医院骨科杨惠林教授团队在《Innovation》上发表了其研究成果:通过双通道挤出式生物打印精确研制了在分层层中同时负载关节软骨祖细胞(articular cartilage progenitor cells, ACPC)和骨间充质干细胞(bone mesenchymal stem cells, BMSC)的各向异性双细胞活性水凝胶(anisotropic bicellular living hydrogels, ABLH),并通过实验证实ABLHs在体内表现出令人满意的软骨和软骨下骨同步再生能力[11]。
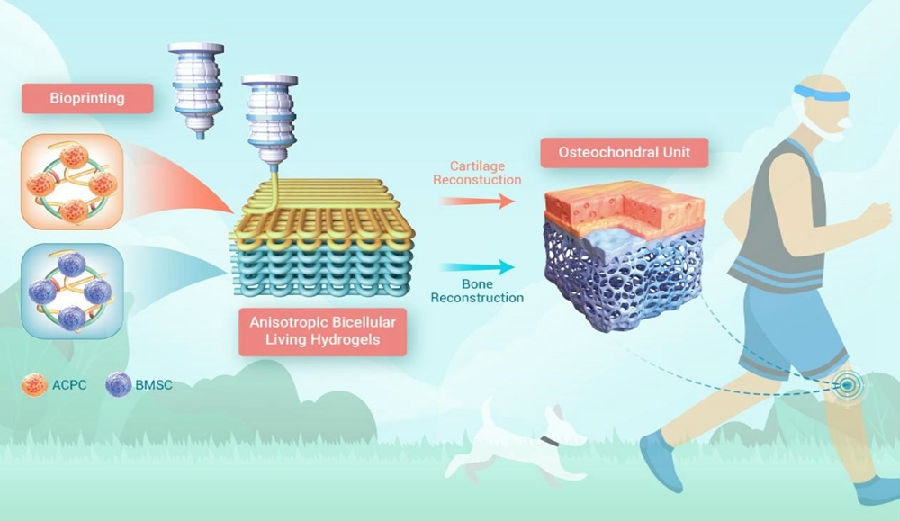
图3 各向异性双细胞活性水凝胶ABLH
浙江大学组织工程与再生医学实验室欧阳宏伟教授团队在《Biofabrication 》上发表的成果提到:其团队利用数字光处理(digital light processing, DLP)技术一步完成了具有精确控制结构的一体化双层支架的生物3D打印。支架上层有“莲形”和“放射状”分布孔,底层有“莲形”分布孔,分别引导和促进软骨细胞和骨髓间充质干细胞向缺损区域迁移。通过调节孔径大小可以方便地调节支架的力学性能。结果表明,在细胞迁移实验、皮下植入和原位植入过程中,支架多孔结构允许更多的细胞浸润到“莲花状”和“放射状”分布的孔隙中,更有助于骨软骨的修复。动物实验亦证实该一体化双层支架对兔骨软骨缺损具有良好的修复作用[12]。上述两篇文章表明复杂仿生结构的支架材料对于软骨修复更加有利,而生物3D打印技术在制备类似复杂结构方面具有巨大的优势。
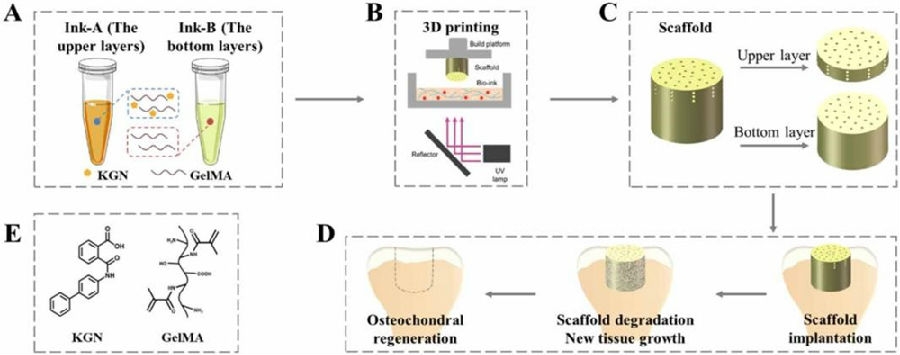
图4 用于骨软骨缺损再生的3D打印仿生支架示意图
3、影响因素
作为组织工程三要素之一的“影响因素”所涉及的方面很多,包括细胞因子、生长因子、微环境等诸多方面。中国人民解放军总医院骨科研究所郭全义教授团队在《Advanced Science》上综述了关节炎性内环境对干细胞以及关节软骨再生的影响:文中认为软骨再生的潜能与关节的炎症性微环境(articular inflammatory microenvironment, AIME)密切相关。理想状态下的AIME应经过三个阶段。早期AIME会释放危险信号,募集M1型巨噬细胞清除坏死组织,抑制干细胞黏附。在第二阶段,M2型巨噬细胞会主导AIME募集和诱导干细胞分化,促进软骨组织的初始形成。在AIME后期阶段会发生炎症细胞和因子的清除,机械应力下软骨形态的重塑以及AIME的重新建立。对于不同时空命运的干细胞,应通过调控AIME来引导干细胞发挥其最大潜能并向软骨分化。为应对AIME微环境的动态变化,设计响应性、多层次材料对恢复正常AIME和指导干细胞命运具有重要意义[13]。
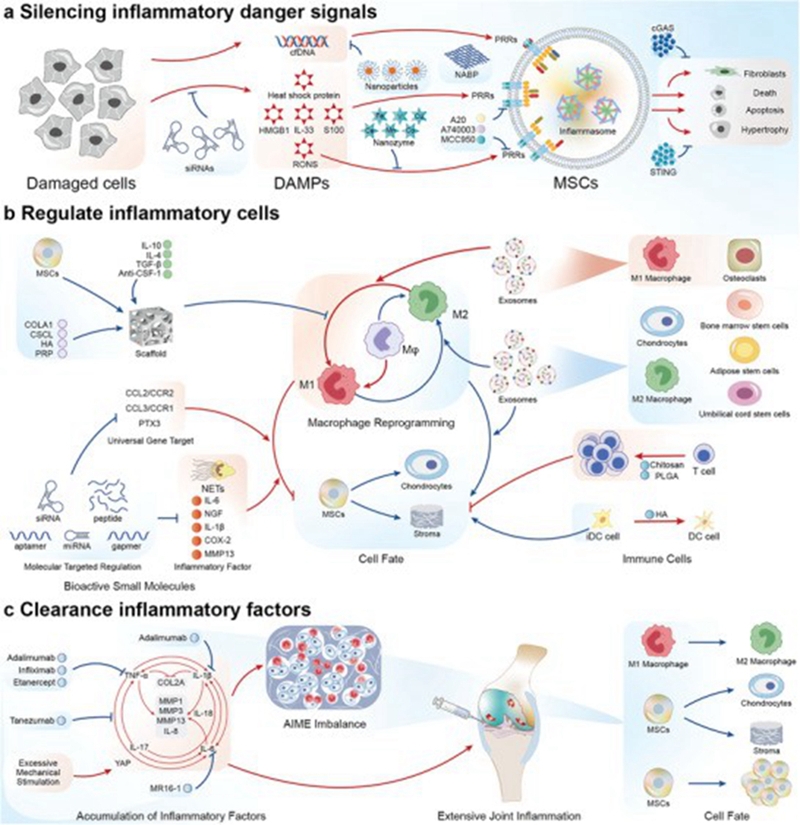
图5 AIME演变与干细胞命运相互作用
另外多种生物活性因子,如SOX-9,BMP-2,SDF-1等,以及来自自体组织的非细胞生物活性因子浓聚物已被证明在促进软骨再生中发挥重要作用。四川大学华西医院骨科运动医学中心付维力教授团队在《American Journal of Sports Medicine》上发表其研究成果:通过体外实验证实富血小板血浆(PRP)可以增强外周血间充质干细胞(PBMSCs)的生物活性, PBMSCs+PRP可以通过抑制IL-1β处理的OA软骨细胞中的炎症信号来改善ECM退化,并通过动物实验证实关节腔注射PBMSCs+PRP可有效减轻OA进展[14]。
此外,非编码RNA(ncRNAs)如miRNA、lncRNA和circRNA等,已被证明可以促进软骨细胞分化、增殖和保留,特别是circRNA因其对RNase的抗性和比线性RNA更高的稳定性在基因治疗研究中更受欢迎。浙江大学医学院附属第一医院骨科赵凤朝教授团队在《Clinical and Translational Medicine》上发表的最新研究表明circARPC1B可通过阻断波形蛋白-SYVN1 结合来抑制波形蛋白降解,并通过体内外实验证明了circARPC1B可以防止软骨 ECM降解,从而抑制OA进展[15]。
总结
本文主要从关节软骨再生修复的基础——组织工程核心三要素:种子细胞、细胞支架、影响因素三大方面综述了近年来在这三个领域的主要研究成果。软骨生物学和修复机制的复杂性是一个动态演变的系统,多种因素相互作用,从分子、细胞和力学角度来看,软骨对损伤的反应及其再生机制在急性和慢性损伤情况下存在差异[16]。事实上,炎症和免疫细胞在急性软骨损伤的再生过程中会被适当地激活,但如果不得到解决,则会进入更为有害的慢性病理状态[17]。同样,细胞命运途径,如自噬,衰老或代谢变化,可有助于恢复急性损伤修复反应期间的稳态,但如果过程延长,也可抑制软骨再生[18]。这些复杂的机制对软骨损伤治疗策略的定义以及创新治疗方法的发展提出了挑战,不同个体相应的临床表型和分子分型的多样性限制了“一刀切”或“一劳永逸”的解决方案,多种方法相结合的联合治疗策略未来可能会成为新常态。在未来的临床应用中必须考虑患者的各种相关因素,包括年龄、性别以及合并症等,以实现量身定制且有效的再生治疗。
目前越来越多各种不同的假说可以解释为什么软骨不能自发再生,并发生一系列事件,最终导致退行性改变和骨关节炎。这些假说可能与细胞衰竭、力学破坏、炎症应激或代谢应激等广泛相关。在当前的关节软骨再生修复研究领域,研究人员试图将设想的治疗策略(包括细胞治疗、生物材料、药物等)与这些假说进行逻辑连接。然而,迄今为止,没有任何一种治疗策略能够在软骨退变的晚期阶段实现天然透明软骨再生。因此尽管目前在再生医学与关节外科领域这领域研究取得了大量的可喜的进展,但是临床上的关节软骨再生修复依旧任重而道远。
作者简介

钱齐荣,教授、主任医师、博士研究生导师,现为上海长征医院骨科副主任,关节外科主任,文职二级。
学术任职:中华医学会骨科学分会关节外科学组委员;中国研究型医院学会骨科加速康复学专业委员会副主任委员;中国医师协会骨科医师分会骨与关节畸形学组副组长;上海市医学会骨科专科分会委员兼关节外科学组组长;上海市医学会创伤专科分会关节镜学组副组长;全军骨科专业委员会关节外科学组副组长;科技部、教育部、国家卫健委特聘专家;国家自然科学基金评审专家等。
以第一作者与通讯作者发表论文50余篇, SCI收录40余篇,单篇最高分值19.309。以第一申请人获得科技部重大专项子课题、国家自然科学基金、上海市科委基础研究重大重点项目及其他省部级科研基金共11项,获各类专利29项,其中发明专利3项;参编专著15部,主译专著1部。获得军队科技进步奖和临床医学成果二等奖等4项。

周义钦,上海长征医院关节外科主任助理,主治医师,医学博士,美国匹兹堡大学访问学者。
学术任职:国际华人骨科研究学会(ICMRS)会员,上海市医学会创伤专科分会关节镜学组委员。《Cell and Tissue Research》《Stem Cells International》等SCI杂志专业审稿人。
以第一/通讯作者发表SCI论文24篇,最高IF:15.100分。现主持国家自然科学基金1项,海军军内专项课题1项,以主要参与人参与国家重点研发计划1项,国家自然科学基金面上项目2项,海军军内科研计划1项。参编专业领域专著5部,其中中文专著3部,英文专著2部;并曾受邀在美国、韩国等国际会议上报告发言。

韩亚光,中共党员,外科学博士,上海长征医院关节外科住院医师。
博士期间共发表SCI论文19篇,其中一作/共一8篇,最高IF:15.100,参编/编译专著2部,作为主要研究者参与国家重点研发计划1项,国家自然科学基金面上项目2项,上海市课题2项。
参考文献:
[1] Y. Zhou, H. Li, D. Xiang, J. Shao, Q. Fu, Y. Han, J. Zhu, Y. Chen, Q. Qian, The clinical efficacy of arthroscopic therapy with knee infrapatellar fat pad cell concentrates in treating knee cartilage lesion: a prospective, randomized, and controlled study, J Orthop Surg Res, 16 (2021) 87.
[2] L. Huang, S. Zhang, J. Wu, B. Guo, T. Gao, S.Z.A. Shah, B. Huang, Y. Li, B. Zhu, J. Fan, L. Wang, Y. Xiao, W. Liu, Y. Tian, Z. Fang, Y. Lv, L. Xie, S. Yao, G. Ke, X. Huang, Y. Huang, Y. Li, Y. Jia, Z. Li, G. Feng, Y. Huo, W. Li, Q. Zhou, J. Hao, B. Hu, H. Chen, Immunity-and-matrix-regulatory cells enhance cartilage regeneration for meniscus injuries: a phase I dose-escalation trial, Signal Transduct Target Ther, 8 (2023) 417.
[3] A. Goshima, Y. Etani, M. Hirao, S. Yamakawa, G. Okamura, A. Miyama, K. Takami, T. Miura, Y. Fukuda, T. Kurihara, N. Ochiai, S. Oyama, S. Otani, M. Tamaki, T. Ishibashi, T. Tomita, T. Kanamoto, K. Nakata, S. Okada, K. Ebina, Basic fibroblast growth factor promotes meniscus regeneration through the cultivation of synovial mesenchymal stem cells via the CXCL6-CXCR2 pathway, Osteoarthritis Cartilage, 31 (2023) 1581-1593.
[4] Z.-L. Li, X.-T. Li, R.-C. Hao, F.-Y. Wang, Y.-X. Wang, Z.-D. Zhao, P.-L. Li, B.-F. Yin, N. Mao, L. Ding, H. Zhu, Human osteoarthritic articular cartilage stem cells suppress osteoclasts and improve subchondral bone remodeling in experimental knee osteoarthritis partially by releasing TNFAIP3, Stem Cell Res Ther, 14 (2023) 253.
[5] L. Fu, L. Li, Q. Bian, B. Xue, J. Jin, J. Li, Y. Cao, Q. Jiang, H. Li, Cartilage-like protein hydrogels engineered via entanglement, Nature, 618 (2023) 740-747.
[6] Y. Li, L. Li, M. Wang, B. Yang, B. Huang, S. Bai, X. Zhang, N. Hou, H. Wang, Z. Yang, C. Tang, Y. Li, W. Yuk-Wai Lee, L. Feng, M.D. Tortorella, G. Li, O-alg-THAM/gel hydrogels functionalized with engineered microspheres based on mesenchymal stem cell secretion recruit endogenous stem cells for cartilage repair, Bioact Mater, 28 (2023) 255-272.
[7] T. Vinikoor, G.K. Dzidotor, T.T. Le, Y. Liu, H.-M. Kan, S. Barui, M.T. Chorsi, E.J. Curry, E. Reinhardt, H. Wang, P. Singh, M.A. Merriman, E. D'Orio, J. Park, S. Xiao, J.H. Chapman, F. Lin, C.-S. Truong, S. Prasadh, L. Chuba, S. Killoh, S.-W. Lee, Q. Wu, R.M. Chidambaram, K.W.H. Lo, C.T. Laurencin, T.D. Nguyen, Injectable and biodegradable piezoelectric hydrogel for osteoarthritis treatment, Nat Commun, 14 (2023) 6257.
[8] L. Bai, Q. Han, Z. Han, X. Zhang, J. Zhao, H. Ruan, J. Wang, F. Lin, W. Cui, X. Yang, Y. Hao, Stem Cells Expansion Vector via Bioadhesive Porous Microspheres for Accelerating Articular Cartilage Regeneration, Adv Healthc Mater, 13 (2024) e2302327.
[9] J. Wu, Y. Han, Q. Fu, Y. Hong, L. Li, J. Cao, H. Li, Y. Liu, Y. Chen, J. Zhu, J. Shao, P. Fu, H. Wu, D. Cui, B. Wang, Y. Zhou, Q. Qian, Application of tissue-derived bioink for articular cartilage lesion repair, Chemical Engineering Journal, 450 (2022) 138292.
[10] J. Wu, L. Fu, Z. Yan, Y. Yang, H. Yin, P. Li, X. Yuan, Z. Ding, T. Kang, Z. Tian, Z. Liao, G. Tian, C. Ning, Y. Li, X. Sui, M. Chen, S. Liu, Q. Guo, Hierarchical porous ECM scaffolds incorporating GDF-5 fabricated by cryogenic 3D printing to promote articular cartilage regeneration, Biomater Res, 27 (2023) 7.
[11] Y. Zhang, D. Li, Y. Liu, L. Peng, D. Lu, P. Wang, D. Ke, H. Yang, X. Zhu, C. Ruan, 3D-bioprinted anisotropic bicellular living hydrogels boost osteochondral regeneration via reconstruction of cartilage-bone interface, Innovation (Camb), 5 (2024) 100542.
[12] Y. Gu, Y. Zou, Y. Huang, R. Liang, Y. Wu, Y. Hu, Y. Hong, X. Zhang, Y.-C. Toh, H. Ouyang, S. Zhang, 3D-printed biomimetic scaffolds with precisely controlled and tunable structures guide cell migration and promote regeneration of osteochondral defect, Biofabrication, 16 (2023).
[13] S. He, H. Deng, P. Li, J. Hu, Y. Yang, Z. Xu, S. Liu, W. Guo, Q. Guo, Arthritic Microenvironment-Dictated Fate Decisions for Stem Cells in Cartilage Repair, Adv Sci (Weinh), 10 (2023) e2207715.
[14] K. Zhang, T. Xu, H. Xie, J. Li, W. Fu, Donor-Matched Peripheral Blood-Derived Mesenchymal Stem Cells Combined With Platelet-Rich Plasma Synergistically Ameliorate Surgery-Induced Osteoarthritis in Rabbits: An In Vitro and In Vivo Study, Am J Sports Med, 51 (2023) 3008-3024.
[15] J. Li, X. Li, S. Zhou, Y. Wang, T. Ying, Q. Wang, Y. Wu, F. Zhao, Circular RNA circARPC1B functions as a stabilisation enhancer of Vimentin to prevent high cholesterol-induced articular cartilage degeneration, Clin Transl Med, 13 (2023) e1415.
[16] Z. Wang, H. Le, Y. Wang, H. Liu, Z. Li, X. Yang, C. Wang, J. Ding, X. Chen, Instructive cartilage regeneration modalities with advanced therapeutic implantations under abnormal conditions, Bioact Mater, 11 (2022) 317-338.
[17] M. Li, H. Yin, Z. Yan, H. Li, J. Wu, Y. Wang, F. Wei, G. Tian, C. Ning, H. Li, C. Gao, L. Fu, S. Jiang, M. Chen, X. Sui, S. Liu, Z. Chen, Q. Guo, The immune microenvironment in cartilage injury and repair, Acta Biomater, 140 (2022) 23-42.
[18] M.T. Valenti, L. Dalle Carbonare, D. Zipeto, M. Mottes, Control of the Autophagy Pathway in Osteoarthritis: Key Regulators, Therapeutic Targets and Therapeutic Strategies, Int J Mol Sci, 22 (2021).


 京公网安备11010502051256号
京公网安备11010502051256号